- 673.00 KB
- 2023-05-11 发布
非选择必考题标准练(二)
满分:58分
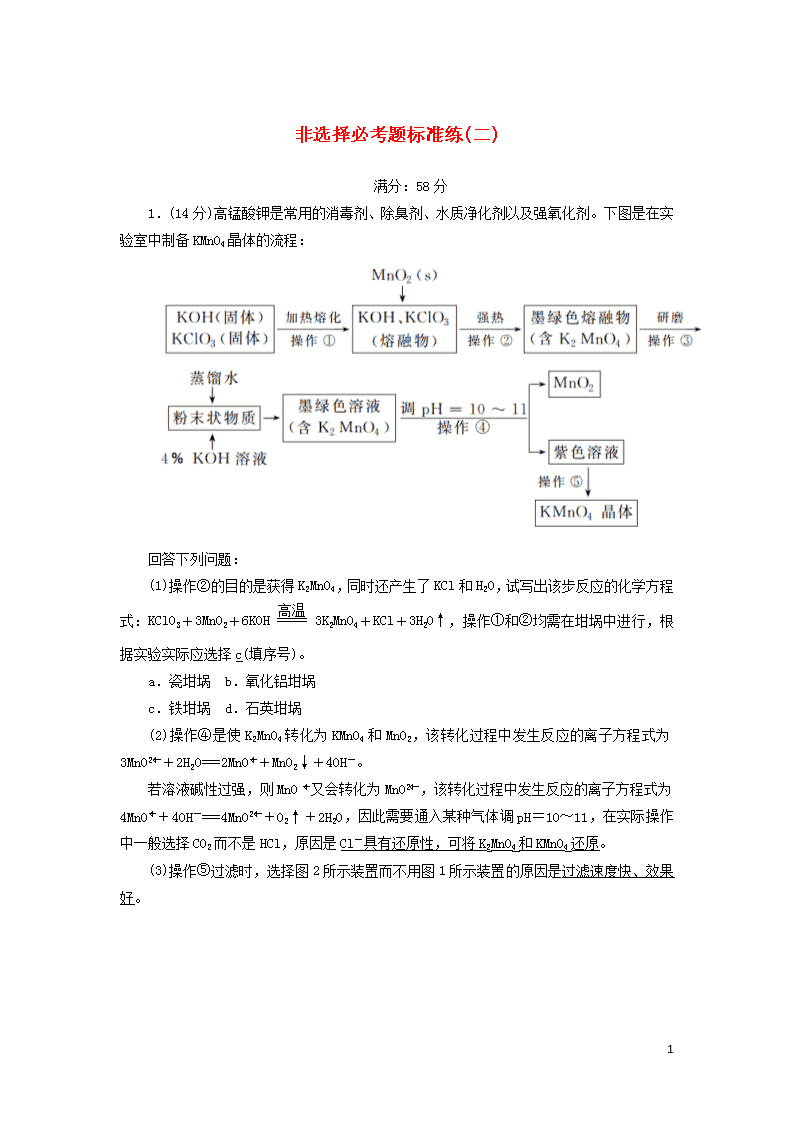
1.(14分)高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂。下图是在实验室中制备KMnO4晶体的流程:
回答下列问题:
(1)操作②的目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式:KClO3+3MnO2+6KOH3K2MnO4+KCl+3H2O↑,操作①和②均需在坩埚中进行,根据实验实际应选择c(填序号)。
a.瓷坩埚 b.氧化铝坩埚
c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为3MnO+2H2O===2MnO+MnO2↓+4OH-。
若溶液碱性过强,则MnO又会转化为MnO,该转化过程中发生反应的离子方程式为4MnO+4OH-===4MnO+O2↑+2H2O,因此需要通入某种气体调pH=10~11,在实际操作中一般选择CO2而不是HCl,原因是Cl-具有还原性,可将K2MnO4和KMnO4还原。
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是过滤速度快、效果好。
9
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为MnO-e-===MnO,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是电解较长时间后,阳极产生的MnO在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,MnO转化为MnO,溶液颜色由紫色转变为绿色)。
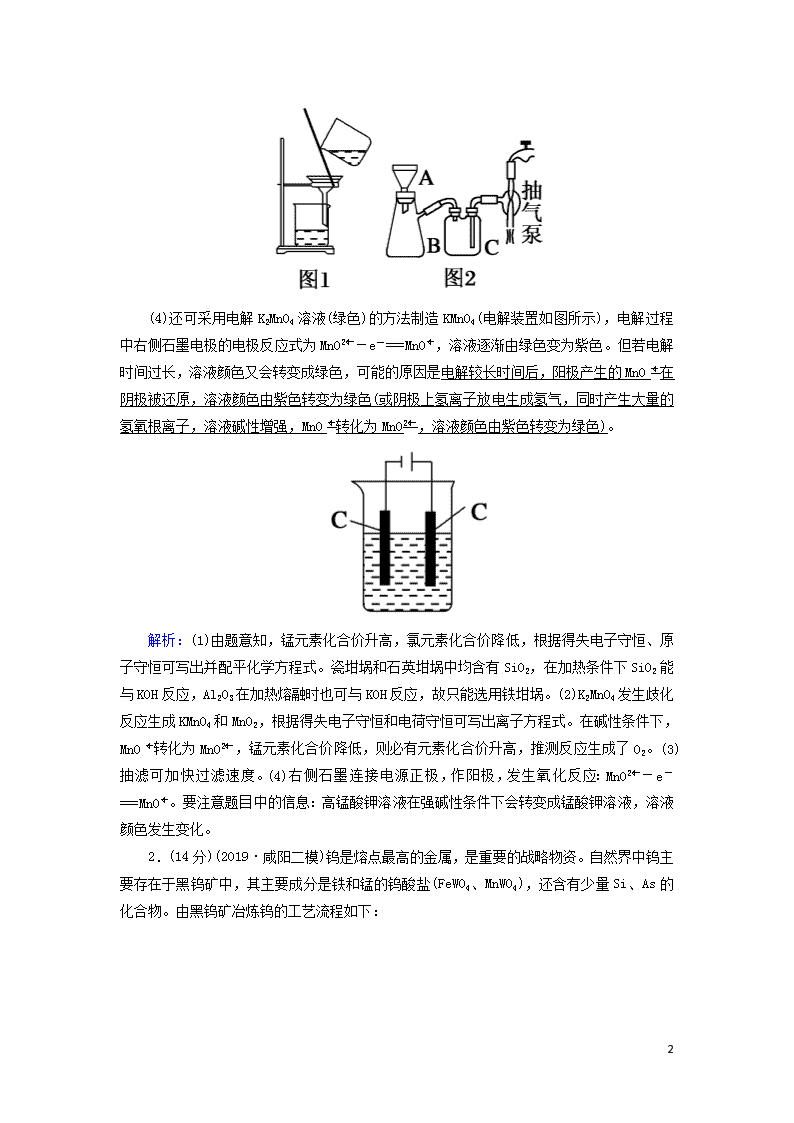
解析:(1)由题意知,锰元素化合价升高,氯元素化合价降低,根据得失电子守恒、原子守恒可写出并配平化学方程式。瓷坩埚和石英坩埚中均含有SiO2,在加热条件下SiO2能与KOH反应,Al2O3在加热熔融时也可与KOH反应,故只能选用铁坩埚。(2)K2MnO4发生歧化反应生成KMnO4和MnO2,根据得失电子守恒和电荷守恒可写出离子方程式。在碱性条件下,MnO转化为MnO,锰元素化合价降低,则必有元素化合价升高,推测反应生成了O2。(3)抽滤可加快过滤速度。(4)右侧石墨连接电源正极,作阳极,发生氧化反应:MnO-e-===MnO。要注意题目中的信息:高锰酸钾溶液在强碱性条件下会转变成锰酸钾溶液,溶液颜色发生变化。
2.(14分)(2019·咸阳二模)钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含有少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
9
已知:①滤渣Ⅰ的主要成分是Fe2O3、MnO2;②上述流程中,钨的化合价只有在最后一步发生改变;③常温下钨酸溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出FeWO4在熔融条件下发生碱分解生成Fe2O3的化学方程式:4FeWO4+O2+8NaOH2Fe2O3+4Na2WO4+4H2O。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子含有SiO、HAsO、HAsO等,则“净化”过程中,加入H2O2时发生反应的离子方程式为HAsO+H2O2===HAsO+H2O,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度的升高而减小。如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则:
①T1”或“<”);T1 ℃时Ksp(CaWO4)=1×10-10。
②向钨酸钠溶液中加入石灰乳会得到大量钨酸钙,发生反应的离子方程式为WO+Ca(OH)2===CaWO4+2OH-。
解析:(1)由流程图和信息知,钨的化合价只有在最后一步发生改变,WO3中W的化合价为+6,则钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,Fe的化合价为+2,FeWO4
9
在熔融条件下发生碱分解反应,由流程图可知有空气中的氧气和NaOH参加反应,生成Fe2O3、Na2WO4,氧化剂为O2,配平方程式得4FeWO4+8NaOH+O22Fe2O3+4Na2WO4+4H2O。(2)加入H2O2时阴离子HAsO能被氧化为HAsO,离子方程式为HAsO+H2O2===HAsO+H2O;加入MgCl2生成沉淀,结合溶液中存在的阴离子,滤渣Ⅱ是MgSiO3、MgHAsO4。(3)①氢氧化钙和钨酸钙的溶解度均随温度升高而减小,Ksp值也随之减小,由图象可知,在阳离子浓度相同时T1 ℃的阴离子浓度大于T2 ℃的阴离子浓度,则T1 ℃对应的Ksp大于T2 ℃对应的Ksp,所以T1p2>p1。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=0.002_5_mol·(L·min)-1。
9
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为0.022_mol·L-1(保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp= MPa。
解析:(1)根据盖斯定律,由反应①-反应②得CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-40 kJ·mol-1。(2)反应①为反应前后气体分子数不变的反应,容器容积不变,压强始终保持不变,根据压强不能判断反应是否达到平衡状态,A项错误;该反应的反应物和生成物均为气体,且容器容积不变,则混合气体的密度始终保持不变,据此不能判断反应是否达到平衡状态,B项错误;化学平衡常数只受温度影响,由于温度不变,不能由此判断反应是否达到平衡状态,C项错误;生成1 mol H—O键,同时生成1 mol H—S键,说明反应达到平衡状态,D项正确。(3)设反应达到平衡时,转化的COS的物质的量为x mol,根据三段式法可确定,平衡时COS(g)、H2(g)、H2S(g)、CO(g)的物质的量分别为(2-x) mol、(1-x) mol、x mol、x mol,根据T1 ℃时有K正=K逆得=,解得x=,则COS的平衡转化率为×100%=33.3%。(4)该反应为气体分子数增大的反应,温度一定时,压强越小,H2S的平衡转化率越高,故压强p3>p2>p1。(5)根据题图2可看出在950 ℃,压强为p3时,H2S的平衡转化率为30%,即反应的H2S的物质的量为0.5 mol×30%=0.15 mol,由于化学方程式中H2S和H2的化学计量数相同,则v(H2)=v(H2S)==0.002 5 mol·(L·min)-1。(6)根据题图2可知压强为p2、温度为975 ℃时,H2S的平衡转化率为40%,即分解的H2S为0.5 mol×40%=0.2 mol,利用三段式法可求出平衡时H2S(g)、H2(g)、S2(g)的物质的量浓度分别为0.15 mol·L-1、0.10 mol·L-1和0.05 mol·L-1,则Kc= mol·L-1≈0.022 mol·L-1。平衡时H2S(g)、H2(g)、S2(g)的物质的量分别为0.3 mol、0.2 mol和0.1 mol,即对应的平衡分压分别为p2、p2、p2,则此时对应的Kp==== MPa。
4.(15分)香料G的一种合成工艺如图所示。
9
已知:ⅰ.A的分子式为C5H8O,其核磁共振氢谱显示有两组峰,其峰面积之比为1∶1。
请回答下列问题:
(1)G中含氧官能团的名称为酯基,B生成C的反应类型为消去反应。
(2)A的结构简式为。
(3)写出D→E的化学方程式:+NaOHNaBr+。
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是KMnO4(H+)在氧化醛基的同时,还可以氧化碳碳双键。
9
①能发生银镜反应
②能与溴的四氯化碳溶液发生加成反应
③苯环上有2个取代基
(6)以2丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。
请用以下方式表示:
9
9
9