- 871.00 KB
- 2021-06-26 发布
包九中2016-2017学年度第二学期期中考试
高二年级化学试卷
可能用到的相对原子量:
H-l C-12 N-14 O-16 Na-23 Cl-35.5 Ca-40 S-32 Mg-24 Si-28
第I卷 选择题(共45分)
选择题(本题共18小题,1-9每题2分,10-18每题3分,只有一个选项符合题意,共45分)
1.下列有关化学用语不正确的是
A.甲醛的电子式: B.Cl-的结构示意图
C. S2-核外电子排布式ls22s22p63s23p6 D.碳-12原子构成
2.下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为ls22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子
D.同一主族的X原子和Y原子
3.下列原子的价电子排布中,对应于第一电离能最大的是
A. 3s23p2 B. 2s22p3 C. 3s23p3 D. 3s23p4
4.己知H2O2的分子空间结构如图,两个平面的夹角为930,两个O—H键与O—O键之间的夹角均为960。有关H2O2结构的说法中不正确的是
A.过氧化氢分子中氧原子sp3杂化 B. 易溶于有机溶剂
C.过氧化氢分子间存在氢键 D.H2O2是极性分子
5.下列分子或离子与SO42-互为等电子体的是
A.SiH4 B.CCl4 C.NF3 D.NH4+
6.
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象说法正确的是
A.反应前后c(Cu2+)不变 B. [Cu (NH3)4]SO4是离子化合物,易溶于水和乙醇
C. [Cu(NH3)4]2+中Cu2+提供空轨道 D.用硝酸铜代替硫酸铜实验,不能观察到同样的现象
7. 关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的Is轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子能量相近的s轨逆;和p轨道混合形成的一组新轨道
D.AB3型的共价化合物,其中心原子a均采用sp2杂化轨道成键
8. 下列有关说法合理的是
A.所有的有机物都可以燃烧
B.—定条件下,甲烷、苯、乙酸、乙醉、油脂、淀粉都可以发生取代反应
C.糖类、油脂、蛋白质都厲于高分子化合物
D.石油的分馏、裂化、裂解和煤的干馏都厲于化学变化
9. 氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子 ()内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子之间存在氢键。则两者的熔点.沸点的相对大小关系是
A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计
10. 己知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D.气态氢化物的稳定性:HnY小于HmX
11.下列关于丙烯(CH3—CH = CH2)的说法不正确的
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中碳原子有两种杂化方式
C.丙烯分子至少有六个原子在同一平面上 D.丙烯分子中3个碳原子在同一直线上
12.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于1
50,若己知其中氧的质量分数为50%,则分子中碳原子的个数最多为
A.4 B.5 C.6 D.7
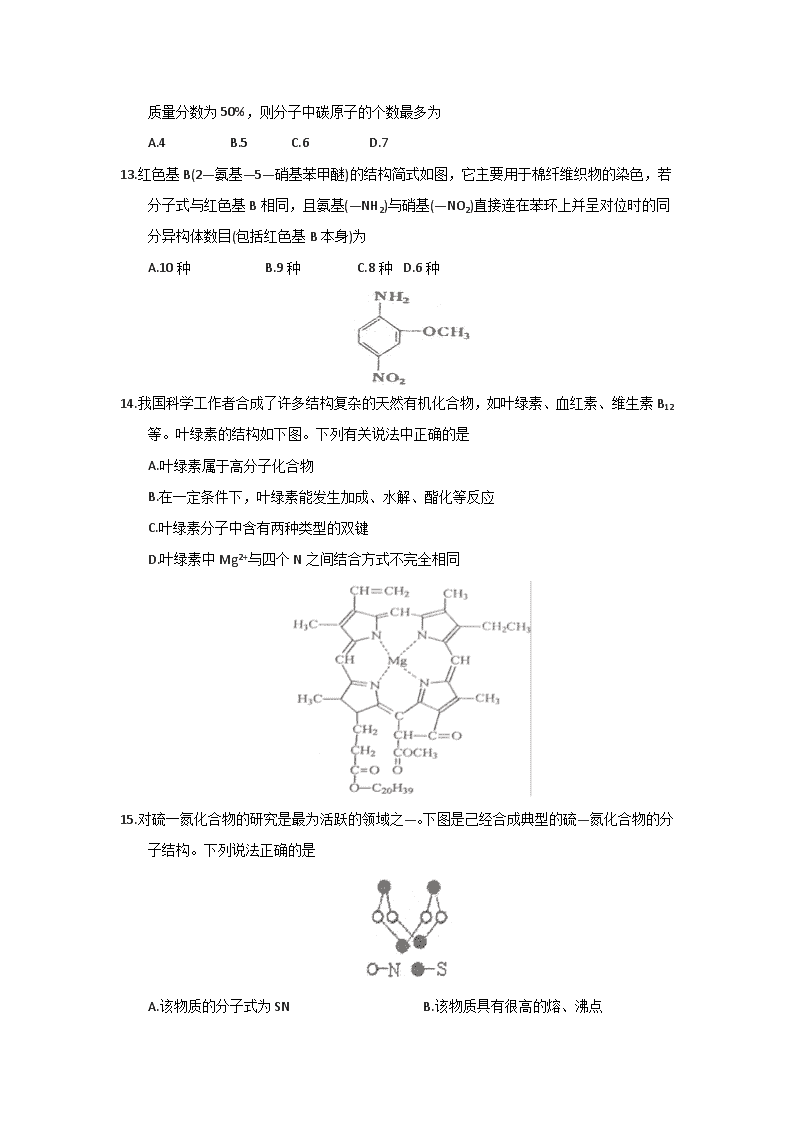
13.红色基B(2—氨基—5—硝基苯甲醚)的结构简式如图,它主要用于棉纤维织物的染色,若分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B本身)为
A.10种 B.9种 C.8种 D.6种
14.我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等。叶绿素的结构如下图。下列有关说法中正确的是
A.叶绿素属于高分子化合物
B.在一定条件下,叶绿素能发生加成、水解、酯化等反应
C.叶绿素分子中含有两种类型的双键
D.叶绿素中Mg2+与四个N之间结合方式不完全相同
15.对硫一氮化合物的研究是最为活跃的领域之―。下图是己经合成典型的硫—氮化合物的分子结构。下列说法正确的是
A.该物质的分子式为SN B.该物质具有很高的熔、沸点
C.该分子是非平面的八元环结构 D.该物质与S2N2互为同素异形体
16.前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种
A.3种 B.4种 C.5种 D.6种
17.三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在—定条件下直接反应得到:
4NH3+3F2 = NF3+3NH4F。下列有关NF3的叙述不正确的是
A.NF3是一种极性分子 B.NF3提供孤电子对的能力比NH3强
C.NF3中的N呈+3价 D.NF3中的N采取sp3杂化成键
18.尼泊金甲酯()是苯的含氧衍生物,在化妆品中可作防腐剂。其一种同分异构体M,满足如下条件:①含有苯环,②含有碳碳双键,③苯环上—氯取代物只有一种。尼泊金甲酯的另一种同分异构体N,能发生银镜反应,也能与Na〇H溶液反应生C8H7O3Na。下列推论合理的是
A.lmol尼泊金甲酯能与1molNaOH反应生成对应的钠盐
B.符合题述条件的有机物m有两种
C.有机物N一定不能发生酯化反应
D.符合条件的有机物M易溶于水中
第2卷非选择题(共55分)
19.(10分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的产物。依据溴乙烷的性质,用下图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物。
操作I:在试管中加入5mL lmolNaOH溶液和5mL溴乙烷,振荡。
操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是 。
(2)观察到 时,表明溴乙烷与NaOH溶液己完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是 。
(4) 为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 。(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
20.(8分)己知A、B、c、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氧化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1) B、C、D的第一电离能由小到大的顺序为 。
(2) B的氢化物的分子空间构型是 ,其中心原子采取的杂化方式是 。
(3)写出化合物AC2的电子式 ,一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4) ECl3形成的配合物的化学式为 。
21. (12分)第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 。与CO互为等电子体的离子为 (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的价电子排布图式是 , Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 .
A.直线形;三角锥形 B.V形;三角锥形
C.直线形:平面三角形 D.V形;平面三角形
22. (15分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD, BAD的结构简式为:
BAD的合成路线如下(己知G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程是引入羧基的反应):
试回答下列问题:
(1)写出Y的结构简式 ;E的含氧官能团名称 。
(2)属于加成反应的有 (填数字序号)。
(3) 1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4) 写出下列反应的化学方程式:
反应④: ;
F+E→: ;
(5) E有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式 。
A.能发生银镜反应 B.遇FeCl3溶液显紫色 C.核磁共振氢谱图中有4个吸收峰
23. (10分)为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有①至⑧共八种气体在大气中的体积百分比及其温室效应指数。结合表中列出的八种气体,回答下列各题:
选
项
物
质
大气中
的含量
温室效
应指数
选
项
物
质
大气中
的含量
温室效
应指数
①
O2
21
0
⑤
N2O
3×10-5
160
②
H2O
1
0.1
⑥
O3
4×10-6
2000
③
CO2
0.03
1
⑦
CCl3F
2.8×10-8
21000
④
CH4
2×10-4
30
⑧
CCl2F2
4.8×10-8
25000
(1)下列由极性键形成的极性分子是 。
A.H2O B.CO2 C.CH4 D.CCl3F E.CCl2F2
(2)下列说法正确的是 。
A.N2O与CO2, CC13F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O的沸点是八种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些是强温室气体,下列推测不正确的是 .
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHC1FCF3存在手性异构
D.第一电离能:N