- 220.00 KB
- 2021-06-25 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
山西省太原市2018-2019学年高一上学期期末考试
化学试题
1.2018年10月21日,港珠澳大桥正式开通,该桥的建成创下多项世界之最,其中仅大桥主梁使用的钢材42万吨。下列材料中不属于铁合金的是
A. 生铁 B. 铁锈 C. 不锈钢 D. 铁锰合金
【答案】B
【解析】
【分析】
合金是由一种金属元素跟其他金属或非金属元素熔合而成的、具有金属特性的物质,据此判断。
【详解】A. 生铁属于铁合金,A不选;
B. 铁锈的主要成分是氧化铁,不是铁合金,B选;
C. 不锈钢属于铁合金,C不选;
D. 铁锰合金属于铁合金,D不选;
答案选B。
2.下列含 N 的物质中,属于电解质的是
A. N2 B. NO C. NH3 D. HNO3
【答案】D
【解析】
【分析】
溶于水或在熔融状态下能够导电的化合物是电解质,据此判断。
【详解】A. N2是单质,不是电解质也不是非电解质,A不选;
B. NO不能电离出阴阳离子,是非电解质,B不选;
C. 氨气溶于水可以导电,但阴阳离子不是NH3自身电离出来的,是非电解质,C不选;
D. HNO3溶于水电离出阴阳离子,可以导电,是电解质,D选。
答案选D。
【点睛】明确电解质和非电解质的判断依据是解答的关键,注意电解质应是一定条件下本身电离而导电的化合物。有些化合物的水溶液能导电,但溶液中离子不是它本身电离出来的,而是与水反应后生成的物质电离出来的,因此也不是电解质,例如选项C。
3.生活中的下列物质,属于硅酸盐产品的是
A. 陶瓷 B. 水晶 C. 玛瑙 D. 沙子
【答案】A
【解析】
【分析】
硅酸盐指的是硅、氧与其它化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,据此判断。
【详解】A. 陶瓷属于硅酸盐产品,A选;
B. 水晶的主要成分是二氧化硅,不是硅酸盐,B不选;
C. 玛瑙的主要成分是二氧化硅,不是硅酸盐,C不选;
D. 沙子的主要成分是二氧化硅,不是硅酸盐,D不选;
答案选A。
4.下列物质不能用作干燥剂的是
A. 硅胶 B. 浓硫酸 C. Fe2O3 D. 固体 NaOH
【答案】C
【解析】
【分析】
具有吸水性的物质才可以用作干燥剂,据此判断。
【详解】A. 硅胶具有吸水性,可以用作干燥剂,A不选;
B. 浓硫酸具有吸水性,可以用作干燥剂,B不选;
C. Fe2O3没有吸水性,不能用作干燥剂,C选;
D. 固体NaOH具有吸水性,可以用作干燥剂,D不选;
答案选C。
5.下列物质在氯气中燃烧,不产生烟的是
A. 钠 B. 铜 C. 铁 D. 氢气
【答案】D
【解析】
【详解】A、钠在氯气中燃烧反应生成氯化钠,观察到白烟,A不选;
B、铜在氯气中燃烧反应生成氯化铜,产生棕黄色的烟,B不选;
C、铁在氯气中燃烧反应生成氯化铁,产生棕褐色的烟,C不选;
D、氢气在氯气中燃烧生成氯化氢,产生苍白色火焰,不产生烟,D选;
答案选D。
【点睛】注意把握物质反应的现象以及特性为解答的关键,注意烟和雾的区别。
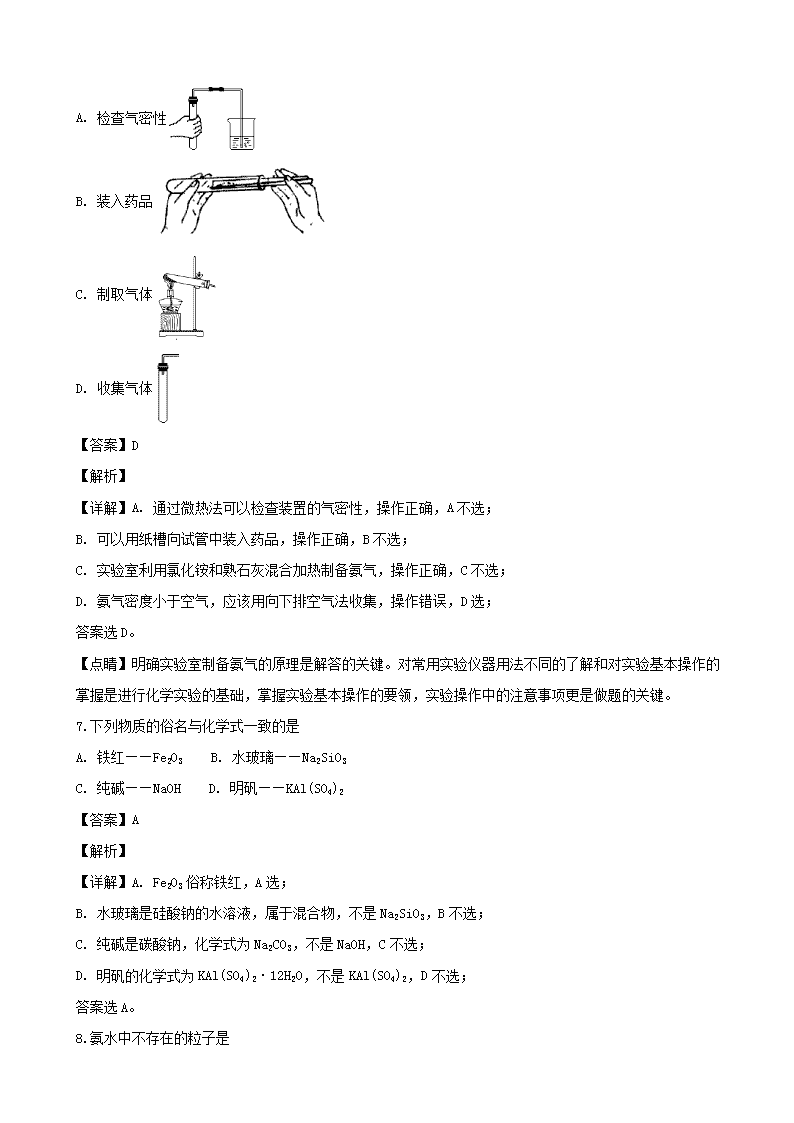
6.下列有关实验室制取氨气的操作中错误的是
A. 检查气密性
B. 装入药品
C. 制取气体
D. 收集气体
【答案】D
【解析】
【详解】A. 通过微热法可以检查装置的气密性,操作正确,A不选;
B. 可以用纸槽向试管中装入药品,操作正确,B不选;
C. 实验室利用氯化铵和熟石灰混合加热制备氨气,操作正确,C不选;
D. 氨气密度小于空气,应该用向下排空气法收集,操作错误,D选;
答案选D。
【点睛】明确实验室制备氨气的原理是解答的关键。对常用实验仪器用法不同的了解和对实验基本操作的掌握是进行化学实验的基础,掌握实验基本操作的要领,实验操作中的注意事项更是做题的关键。
7.下列物质的俗名与化学式一致的是
A. 铁红——Fe2O3 B. 水玻璃——Na2SiO3
C. 纯碱——NaOH D. 明矾——KAl(SO4)2
【答案】A
【解析】
【详解】A. Fe2O3俗称铁红,A选;
B. 水玻璃是硅酸钠的水溶液,属于混合物,不是Na2SiO3,B不选;
C. 纯碱是碳酸钠,化学式为Na2CO3,不是NaOH,C不选;
D. 明矾的化学式为KAl(SO4)2·12H2O,不是KAl(SO4)2,D不选;
答案选A。
8.氨水中不存在的粒子是
A. NH3 B. N3- C. NH4+ D. OH-
【答案】B
【解析】
【详解】氨气溶于水得到氨水,溶于水的氨气部分与水反应生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,则
A. 氨水中存在NH3,A不选;
B. 氨水中不存在N3-,B选;
C. 氨水中存在NH4+,C不选;
D. 氨水中存在OH-,D不选;
答案选B。
【点睛】明确氨水的组成微粒是解答的关键,注意氨气溶于水后并没有全部与水反应,其次要注意一水合氨是一元弱碱,部分电离,最后要注意氨水和液氨的区别。
9.做焰色试验时,用于清洗铂丝的是
A. 盐酸 B. 硫酸 C. 硝酸 D. 碳酸
【答案】A
【解析】
【详解】硫酸难挥发,清洗做焰色反应的铂丝后有残留,硝酸是氧化性酸,碳酸不稳定,属于弱酸,因此做焰色试验时应该用盐酸洗涤铂丝。答案选A。
【点睛】本题主要考查了焰色反应的有关判断,需要注意的是焰色反应是物理变化,不是化学变化,表现的是某一种金属元素的性质,包括单质和化合物。
10.我国古代文献中有许多化学知识的记载,如《淮南万毕术》中提到“曾青得铁则化为铜”,其反应的化学方程式是 Fe+CuSO4=FeSO4+Cu,该反应不属于
A. 复分解反应 B. 置换反应 C. 离子反应 D. 氧化还原反应
【答案】A
【解析】
【详解】A、复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应,因此该反应不是复分解反应,A选;
B、根据反应方程式Fe+CuSO4=FeSO4+Cu可知该反应属于一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,因此是置换反应,B不选;
C、反应中铁和铜元素的化合价发生变化,属于氧化还原反应,C不选;
D、反应在溶液中进行有离子参加和生成,因此属于离子反应,D不选;
答案选A。
11.还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是
A. 反应生成FeO
B. 湿棉花的主要作用是冷却试管,防止炸裂
C. 肥皂液的主要作用是检验生成的H2
D. 铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
【答案】C
【解析】
【详解】A. 铁与水蒸气反应生成Fe3O4,A错误;
B. 湿棉花的作用提供水蒸气反应物,B错误;
C. 使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明“铁与水蒸气”反应生成了H2,C正确;
D. 铁粉与水蒸气反应生成的产物四氧化三铁也可以被磁铁吸引,不能分离出铁,D错误;
答案选C。
12.在无色溶液中大量共存的一组离子是
A. Cu2+、SO42-、K+、Cl- B. Ag+、Cl-、OH-、Na+
C. NO3-、Cl-、Na+、Ca2+ D. NO3-、OH-、Mg2+、Na+
【答案】C
【解析】
【分析】
在溶液中如果离子间发生化学反应,则不能大量共存,结合离子的性质、发生的反应分析判断。
【详解】A. 在水溶液中Cu2+是蓝色的,不能大量共存,A不选;
B. Ag+与Cl-、OH-均反应生成沉淀,不能大量共存,B不选;
C. NO3-、Cl-、Na+、Ca2+在溶液中不反应,且均是无色的,可以大量共存,C选;
D. 在溶液中OH-、Mg2+结合生成氢氧化镁沉淀,不能大量共存,D不选;
答案选C。
13.下列试剂的保存或盛装方法中,错误的是
A. 钠保存在煤油中
B. 铁罐贮存浓硝酸
C. 新制的氯水保存在棕色玻璃瓶中
D. NaOH 溶液盛装在带玻璃塞的玻璃瓶中
【答案】D
【解析】
【详解】A、钠能和氧气、水反应,故钠应隔绝空气和水保存,钠的密度大于煤油,故可以保存在煤油中,A正确;
B、常温下铁遇浓硝酸发生钝化,可以用铁罐贮存浓硝酸,故B正确;
C、氯水见光易分解,故应避光保存,应保存在棕色试剂瓶中,故C正确;
D、NaOH能和玻璃的成分之一的二氧化硅反应,生成具有黏性的硅酸钠将瓶塞与瓶身黏在一起,使瓶塞难以打开,故若用玻璃瓶保存,则应用橡胶塞,不能用玻璃塞,故D错误。
故答案选D。
【点睛】本题考查了常用试剂的保存方法,而试剂的保存方法取决于其性质,特别是化学性质,所以掌握试剂的性质是理解并记忆保存方法的关键。
14.物质X既能与稀盐酸反应,也能与氢氧化钠溶液反应,则X不可能是
A. Al2O3 B. NH4Cl C. NaHCO3 D. Al(OH)3
【答案】B
【解析】
【详解】A. Al2O3是两性氧化物,既能与稀盐酸反应,也能与氢氧化钠溶液反应,A不符合;
B. NH4Cl是强酸的铵盐,能与氢氧化钠溶液反应,与盐酸不反应,B符合;
C. NaHCO3是弱酸的酸式盐,既能与稀盐酸反应,也能与氢氧化钠溶液反应,C不符合;
D. Al(OH)3是两性氢氧化物,既能与稀盐酸反应,也能与氢氧化钠溶液反应,D不符合;
答案选B。
15.实验室用如图所示装置制取Fe(OH)2,下列说法正确的是
A. FeSO4溶液为黄色
B. 苯的作用是隔离氧气
C. 可将苯换成酒精进行实验
D. 沉淀的颜色变化是白色→灰绿色→红褐色
【答案】B
【解析】
【详解】A. FeSO4溶液显浅绿色,A错误;
B. 氢氧化亚铁易被氧化,苯的密度小于水,不溶于水,因此苯的作用是隔离氧气,防止生成的氢氧化亚铁被氧化为氢氧化铁,B正确;
C. 酒精与水互溶,不能隔绝空气,因此不可将苯换成酒精进行实验,C错误;
D. 由于苯隔绝空气,胶头滴管插入硫酸亚铁溶液中,因此可以防止生成的氢氧化亚铁被氧化为氢氧化铁,所以可以得到白色的氢氧化亚铁沉淀,D错误;
答案选B。
【点睛】明确物质的性质特点、苯的作用是解答的关键,注意掌握实验室制备氢氧化亚铁的防氧化措施:将配制溶液的蒸馏水煮沸,驱除溶解的氧气;将盛有氢氧化钠溶液的胶头滴管尖端插入试管里的亚铁盐溶液底部,再慢慢挤出NaOH溶液;在亚铁盐溶液上面加保护层,例如苯或植物油等。
16.下列有关反应的离子方程式,书写正确的是
A. 硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 小苏打与稀盐酸的反应:CO32-+2H+=CO2↑+H2O
C. 向氢氧化钡溶液中滴加稀硫酸:H++OH-=H2O
D. 向AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
【答案】D
【解析】
【详解】A. 硫酸滴在铜片上不反应,不能置换出氢气,A错误;
B. 小苏打是碳酸氢钠,与稀盐酸的反应:HCO3-+H+=CO2↑+H2O,B错误;
C. 向氢氧化钡溶液中滴加稀硫酸生成硫酸钡和水:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O,C错误;
D. 向AlCl3溶液中加入过量氨水生成氢氧化铝沉淀和氯化铵:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,D正确;
答案选D。
17.除去下列物质中混有的少量杂质(括号内为杂质),所用试剂或方法错误的是
物质(杂质)
除杂试剂或方法
A
CO2(SO2)
NaOH溶液
B
汽油(H2O)
分液
C
FeCl3溶液(FeCl2)
Cl2
D
Na2CO3固体(NaHCO3)
加热
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A、二者均与氢氧化钠溶液反应,除去二氧化碳中的二氧化硫应该利用饱和的碳酸氢钠溶液,A错误;
B、汽油不溶于水,可以用分液法分离,B正确;
C、氯气能把氯化亚铁氧化为氯化铁,可以除去氯化铁溶液中的氯化亚铁,C正确;
D、碳酸氢钠受热易分解生成碳酸钠、二氧化碳和水,可以用加热法除去碳酸钠中的碳酸氢钠,D正确。
答案选A。
【点睛】明确物质的性质特点是解答的关键,注意除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
18.用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 30 g NO中所含原子数为2NA
B. 11.2 L Cl2中所含分子数为0.5NA
C. 1 mol•L-1 Na2CO3溶液中的Na+数为2NA
D. 56 g Fe与足量氯气反应,转移的电子数为2NA
【答案】A
【解析】
【详解】A. 30 g NO的物质的量是30g÷30g/mol=1mol,其中所含原子数为2NA,A正确;
B. 氯气所处温度和压强不确定,11.2 L Cl2的物质的量不一定是0.5mol,其中所含分子数不一定为0.5NA,B错误;
C. 1 mol•L-1 Na2CO3溶液的体积不能确定,其中的Na+数不一定为2NA,C错误;
D. 56 g Fe的物质的量是56g÷56g/mol=1mol,与足量氯气反应生成氯化铁,转移的电子数为3NA,D错误;
答案选A。
19.将NaOH溶液逐滴滴入Y的溶液中,生成沉淀的物质的量与NaOH溶液体积的关系如图所示,则Y是
A. AgNO3 B. NaAlO2
C. AlCl3 D. Fe2(SO4)3
【答案】C
【解析】
【分析】
根据图像可知加入氢氧化钠溶液立即产生沉淀,氢氧化钠过量后沉淀又完全溶解,且形成沉淀和沉淀完全溶解消耗的NaOH物质的量之比为3:1,结合物质的性质分析判断。
【详解】A. 向AgNO3溶液中滴加氢氧化钠溶液,有沉淀产生,氢氧化钠过量后沉淀不会溶解,A不符合;
B. 向NaAlO2溶液中滴加氢氧化钠溶液,不会有沉淀产生,B不符合;
C. 向AlCl3溶液中滴加氢氧化钠溶液,产生氢氧化铝沉淀,氢氧化钠过量后氢氧化铝又溶解,C符合;
D. 向Fe2(SO4)3溶液中滴加氢氧化钠溶液,产生氢氧化铁沉淀,氢氧化钠过量后沉淀不溶解,D不符合;
答案选C。
【点睛】明确物质的性质、发生的化学反应是解答的关键,注意图像的答题技巧:看面:弄清纵、横坐标的含义。看线:弄清线的变化趋势,每条线都代表着一定的化学反应过程。看点:弄清曲线上拐点的含义,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。曲线的拐点代表着一个反应过程的结束和开始。
20.向 a g Al2O3、Fe2O3的混合物中加入100mL 0.05mol/L的盐酸中,固体全部溶解,再向其中加入NaOH溶液使Fe3+、Al3+恰好全部转化成沉淀,用去NaOH溶液100mL,则此NaOH溶液的浓度为
A. 0.2mol/L B. 0.1mol/L C. 0.05mol/L D. 无法计算
【答案】C
【解析】
【详解】盐酸的物质的量是0.1L×0.05mol/L=0.005mol,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+
完全沉淀,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl)=0.005mol,根据钠离子守恒有n(NaOH)=n(NaCl)=0.005mol,则氢氧化钠溶液的浓度为:c(NaOH)=0.005mol÷0.1L=0.05mol/L。答案选C。
【点睛】本题考查了混合物反应的计算,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力。
21.中国高铁对实现“一带一路”的战略构想有重要的作用。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和___;
(2)高铁上的信息传输系统使用了光导纤维,其主要成分是___;乘务员使用的无线通话机的芯片材料是___。
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为___。
(4)高铁上的卫生间没有任何异味,是由于所使用的马桶,地漏和洗手盆下水口都是纳米硅胶的高科技产品, 向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为___。
【答案】 (1). 石灰石 (2). SiO2 (3). Si (4). 4HF+SiO2=SiF4+2H2O (5). 2H++SiO32-=H2SiO3(胶体)
【解析】
【分析】
(1)根据生产水泥的原料分析解答;
(2)根据二氧化硅和硅的用途分析判断;
(3)氢氟酸与二氧化硅反应生成四氟化硅和水;
(4)硅酸钠和盐酸反应生成氯化钠和硅酸胶体。
【详解】(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和石灰石;
(2)高铁上的信息传输系统使用了光导纤维,其主要成分是SiO2;硅是半导体,乘务员使用的无线通话机的芯片材料是Si。
(3)氢氟酸与玻璃中的二氧化硅反应生成四氟化硅和水,反应的化学方程式为4HF+SiO2=SiF4+2H2O。
(4)向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为2H++SiO32-=H2SiO3(胶体)。
22.氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。
(1)1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被_______(填“氧化”或“还原”)
(2)贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是_____________________。
(3)泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是__________________。
(4)盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是_____________。
(5)1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是___________________(用化学方程式表示)
【答案】 (1). 氧化 (2). 溶液先变红,后褪色 (3). Ca(ClO)2 (4). 2Al+3Cl22AlCl3 (5). Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
【分析】
(1)根据氯元素的化合价变化分析;
(2)根据氯水的性质分析判断;
(3)根据漂白粉的制备原理分析;
(4)铝在氯气中燃烧生成氯化铝;
(5)根据氯气能与氢氧化钠溶液反应解答。
【详解】(1)将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素化合价从-1价升高到0价,失去电子,发生氧化反应,被氧化;
(2)氯气能溶于水,所得溶液是氯水,氯水显酸性,同时还含有次氯酸还具有漂白性,则向此溶液中滴加紫色石蕊溶液,观察到的现象是溶液先变红,后褪色。
(3)将氯气通入石灰水得到漂白粉,生成物是氯化钙和次氯酸钙,因此漂白粉是由氯化钙和次氯酸钙组成的混合物,漂白粉的有效成分是Ca(ClO)2。
(4)氯气与铝反应生成氯化铝,反应的化学方程式是2Al+3Cl22AlCl3。
(5)氯气有毒,实验室一般用氢氧化钠溶液吸收氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
23.茶是中国人喜爱的一种饮品,茶叶中含有铁元素,可以用以下实验操作检验茶叶中的铁元素
A.取少量茶叶。
B.检验滤液中的 Fe3+。
C.过滤得到滤液。
D.将茶叶灼烧为茶叶灰。
E.用足量稀盐酸溶解茶叶灰,并加蒸馏水稀释。
请回答下列问题。
(1)上述实验操作的正确顺序是___(填序号)
(2)操作 D 所用仪器有:酒精灯、三脚架、泥三角、___、___。
(3)检验滤液中 Fe3+的方法是___,观察到的现象是___。
(4)越来越多的人喜欢用铁壶泡茶,铁壶泡茶时壶中的铁与茶水中的 Fe3+能发生反应,有关的离子方程式是___。
【答案】 (1). ADECB (2). 坩埚 (3). 玻璃棒 (4). 取少量滤液于试管中,向其中滴加 KSCN溶液 (5). 溶液变成红色 (6). Fe+ 2Fe3+=3 Fe2+
【解析】
【分析】
茶叶中含铁等金属元素,灼烧后加稀盐酸溶解,利用KSCN溶液检验铁离子,据此分析判断。
【详解】(1)检验茶叶中的铁元素的正确操作为:A.取少量茶叶;D.将茶叶灼烧为茶叶灰;E.用足量稀盐酸溶解茶叶灰,并加蒸馏水稀释;C.过滤得到滤液;B.检验滤液中的Fe3+。所以上述实验操作的正确顺序是ADECB;
(2)固体灼烧需要坩埚,同时需要玻璃棒搅拌,则操作D所用仪器有:酒精灯、三脚架、泥三角、坩埚、玻璃棒。
(3)一般用KSCN溶液检验铁离子,则检验滤液中Fe3+的方法是取少量滤液于试管中,向其中滴加KSCN溶液,观察到的现象是溶液变成红色。
(4)铁能与溶液中的Fe3+发生反应生成亚铁离子,反应的离子方程式是Fe+2Fe3+=3Fe2+。
【点睛】本题考查了探究茶叶中铁元素的方法及性质实验方案的设计,注意掌握性质实验方案的设计方法,明确探究物质组成的方法,试题培养了学生灵活应用所学知识解决实际问题的能力。
24.A-F为中学化学常见物质,它们的焰色实验均为黄色。其中A为单质,B与C的组成元素相同,且B为淡黄色固体;D、E、F的溶液均显碱性,其中E和F属于盐,E被广泛用于玻璃、造纸和纺织等。它们之间的相互转化关系如下图。(“®”表示一步反应即可转化,部分反应物、生成物和反应条件已略去)
请回答下列问题:
(1)写出下列物质的化学式:B___,C___,E___。
(2)A®D的化学方程式是___。
(3)B®D的化学方程式是___。
(4)区分E和F两种固体的方法是:分别取等量的E和F两种固体少许于试管中,操作,现象和结论是___。
【答案】 (1). Na2O2 (2). Na2O (3). Na2CO3 (4). 2Na + 2H2O = 2NaOH + H2 (5). 2Na2O2 + 2H2O = 4NaOH + O2 (6). 加热试管,将导气管插入澄清石灰水中,
E试管的澄清石灰水没有明显变化, F试管的澄清石灰水变浑浊,说明 F 是 NaHCO3, E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液 ,E试管中产生白色沉淀, F试管中无明显现象)
【解析】
【分析】
A-F为中学化学常见物质,它们的焰色实验均为黄色,因此都含有钠元素。其中A为单质,A是钠;B与C的组成元素相同,且B为淡黄色固体,则B是过氧化钠,C氧化钠;D、E、F的溶液均显碱性,其中E和F属于盐,E被广泛用于玻璃、造纸和纺织等,则E是碳酸钠,F是碳酸氢钠,根据它们之间的相互转化关系可知A、B、C均能转化为D,所以D是氢氧化钠。据此解答。
【详解】根据以上分析可知A是钠,B是过氧化钠,C氧化钠,D是氢氧化钠,E是碳酸钠,F是碳酸氢钠,则
(1)B、C、E的化学式分别是Na2O2、Na2O、Na2CO3。
(2)A→D是钠与水反应生成氢氧化钠和氢气,反应的化学方程式是2Na+2H2O=2NaOH+H2↑。
(3)B→D是过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式是2Na2O2+2H2O=4NaOH+ O2↑。
(4)区分碳酸钠和碳酸氢钠两种固体的方法是:分别取等量的碳酸钠和碳酸氢钠两种固体少许于试管中,加热试管,将导气管插入澄清石灰水中,E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是NaHCO3,E是Na2CO3,或向两试管中分别加入等量的CaCl2溶液,E试管中产生白色沉淀,F试管中无明显现象,说明F是NaHCO3,E是Na2CO3。
25.同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)
①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
【答案】 (1). 3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O (2). 降温结晶 (3). 不会产生污染环境的 NO (4). NO2 (5). 无色 (6). 3NO2 + H2O = 2 HNO3 + NO (7). 取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液 (8). Cu(NO3)2 晶体的热稳定性较差
【解析】
【分析】
(1)铜与稀硝酸反应生成硝酸铜、NO和水,据此书写;
(2)根据硝酸铜的溶解度与温度的关系分析判断;
(3)①根据气体的颜色判断气体的成分;
②二氧化氮溶于水生成硝酸和NO;
③根据氧化铜能溶于酸溶液中,溶液显蓝色分析判断;
④根据实验现象分析判断。
【详解】(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,同时还有NO和水生成,反应的化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)根据图像可知硝酸铜的溶解度受温度影响较大,因此欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、降温结晶、过滤、洗涤、干燥。先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,因此不会产生污染环境的NO,所以此方案优于甲组的方案。
(3)①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,因此红棕色气体是NO2。
②由于二氧化氮溶于水生成硝酸和一氧化氮,所以集气瓶中最终收集到的气体颜色是无色,二氧化氮进入集气瓶后颜色发生变化的原因是由于二氧化氮与水反应,方程式为3NO2+H2O=2HNO3+NO。
③氧化铜是碱性氧化物,能与酸反应,则欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解]的实验方案是取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液。
④根据以上分析可知,由该实验可得出的结论是Cu(NO3)2晶体的热稳定性较差。
【点睛】本题考查了制备实验方案的设计与评价、物质性质实验方案的设计,注意掌握常见元素单质及其化合物性质,明确物质性质实验方案的设计与评价方法,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力。
26.研究表明,二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
请回答下列问题。
(1)雾霾是雾和霾的组合词,二者的分散剂都是________________,雾霾的一种分散质的化学式是____________
(2)燃烧后引起雾霾的一种化石燃料是___________, SO2 还能导致的一种环境问题是_________________
(3)①的化学方程式为____________,其中氧化剂与还原剂的物质的量之比为_____________
(4)工业合成氨的化学方程式为_____________________________, NH3 的一种用途为___________________
(5)鉴别 SO2 和 NH3的方法是_________________________,若观察到____________,则证明气体是 SO2,反之,气体是 NH3。
【答案】 (1). 空气 (2). (NH4)2SO4 (3). 煤 (4). 酸雨 (5). 2SO2+O22SO3 (6). 1:2 (7). N2+3H22NH3 (8). 制冷剂等 (9). 将气体通入到高锰酸钾溶液中 (10). 若观察到紫色褪去
【解析】
【分析】
(1)根据雾和霾都是分散到空气中形成的;根据示意图判断;
(2)根据煤燃烧容易引起雾霾判断;根据二氧化硫的性质解答;
(3)二氧化硫与氧气化合生成三氧化硫,根据元素的化合价变化分析;
(4)工业上利用氮气和氢气化合生成氨气,根据氨气的用途解答;
(5)根据二者的性质差异分析判断。
【详解】(1)雾霾是雾和霾的组合词,二者的分散剂都是空气;根据转化关系图可知雾霾的一种分散质是硫酸铵,其化学式是(NH4)2SO4;
(2)煤燃烧容易引起雾霾,因此燃烧后引起雾霾的一种化石燃料是煤;二氧化硫是酸性氧化物,与水反应生成亚硫酸,亚硫酸易被氧化为硫酸,所以SO2还能导致的一种环境问题是酸雨;
(3)反应①是二氧化硫与氧气化合生成三氧化硫,反应的化学方程式为2SO2+O22SO3
,硫元素化合价升高,氧元素化合价降低,二氧化硫是还原剂,氧气是氧化剂,则其中氧化剂与还原剂的物质的量之比为1:2;
(4)工业合成氨利用的是氢气和氮气的化合反应,反应的化学方程式为N2+3H22NH3,NH3的一种用途为制冷剂等;
(5)二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,则鉴别SO2和NH3的方法是将气体通入到高锰酸钾溶液中,若观察到紫色褪去,则证明气体是SO2,反之气体是NH3。
27.研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
请回答下列问题:
(1)工业生产H2SO4时最后一步反应的化学方程式是_______________________。
(2)反应Ⅰ的化学方程式是_________________。其中氧化产物与还原产物的物质的量之比是________________________。
(3)反应Ⅱ为歧化反应,其中硫元素的化合价是由____________到________________。
(4)反应Ⅲ中硫在氧气中燃烧现象是________________________________。检验生成的二氧化硫的方法是_________________________________________________。观察到的现象是_______________________________。
(5)上述过程中有__________种形式的能量转化,此过程中可能造成一种环境问题是_____________________________。
【答案】 (1). SO3+H2O=H2SO4 (2). 2H2SO42SO2↑+O2↑+2H2O (3). 1:2 (4). +4 (5). 0、+6 (6). 产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体 (7). 将气体通入品红溶液中,过一会后再加热 (8). 品红溶液褪色,且加热后又恢复原色 (9). 4 (10). 酸雨
【解析】
【分析】
(1)工业生产H2SO4时最后一步反应是三氧化硫和水反应生成硫酸,据此书写;
(2)反应Ⅰ是硫酸分解生成氧气、二氧化硫和水,据此书写;根据元素的化合价变化计算;
(3)根据反应物和生成物中硫元素的化合价分析判断;
(4)根据硫燃烧的实验现象分析,利用二氧化硫的漂白性检验;
(5)根据转化关系图判断。
【详解】(1)工业生产H2SO4时最后一步反应是三氧化硫和水反应生成硫酸,反应的化学方程式是SO3+H2O=H2SO4。
(2)反应Ⅰ是硫酸分解生成氧气、二氧化硫和水,反应的化学方程式是2H2SO42SO2↑+O2↑+2H2O。反应中氧元素化合价升高,氧气是氧化产物,硫元素化合价降低,SO2是还原产物,则其中氧化产物与还原产物的物质量之比是1:2。
(3)反应Ⅱ为歧化反应,二氧化硫转化为硫酸和单质硫,因此其中硫元素的化合价是由+4价到+6价和0价。
(4)反应Ⅲ中硫在氧气中生成二氧化硫,燃烧现象是产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体。二氧化硫能使品红溶液褪色,则检验生成的二氧化硫的方法是将气体通入品红溶液中,过一会后再加热,观察到的现象是品红溶液褪色,且加热后又恢复原色。
(5)根据示意图可知有太阳能转化为热能,热能转化为化学能,化学能转化为热能,热能转化为电能,即上述过程中有4种形式的能量转化。由于有二氧化硫产生,则此过程中可能造成的一种环境问题是酸雨。
28.人们常用金属铝和浓氢氧化钠溶液的反应疏通下水管道。请计算: 18 g 金属铝与足量浓氢氧化钠溶液完全反应时,生成标准状况下的氢气的体积是多少?______________
【答案】22.4 L
【解析】
【分析】
根据n=m/M、V=nVm结合方程式计算。
【详解】18g金属铝的物质的量是18g÷27g/mol=2/3mol,根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成氢气的物质的量是2/3mol×3/2=1mol,在标况下的体积是22.4L。
29.某铝合金中含有镁、铜、铝三种金属,现取10g 该铝合金,向其中加入100mL 3mol/L 氢氧化钠溶液,恰好完全反应,请计算该铝合金中铝的质量分数。_________
【答案】81%
【解析】
【分析】
铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,但是金属镁、铜和氢氧化钠之间不会发生反应,根据反应的方程式结合物质的量进行回答即可。
【详解】氢氧化钠的物质的量是0.3mol,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,根据反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2
↑可知消耗金属铝是0.3mol,质量是0.3mol×27g/mol=8.1g,所以该铝合金中铝的质量分数是8.1g/10g×100%=81%。