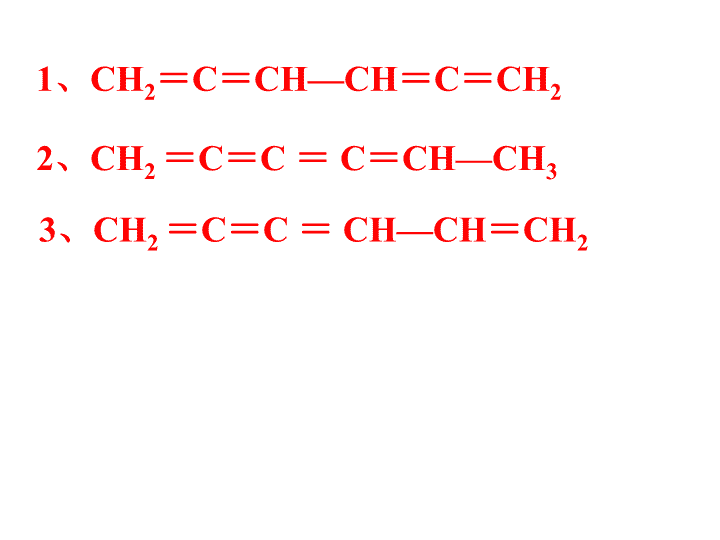- 1.28 MB
- 2021-05-24 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
第二节 来自石油和煤的
两种基本化工原料
第2课时
二、苯
1、CH2=C=CH—CH=C=CH2
2、CH2 =C=C = C=CH—CH3
3、CH2 =C=C = CH—CH=CH2
实验:向盛有1ml苯的两支试管中分别滴加0.5mL溴的四
氯化碳溶液或酸性KMnO4溶液,振荡静置,观察现象。
现象:溴的四氯化碳溶液和酸性KMnO4溶液都不褪色。
实验:向盛有1ml苯的两支试管中分别滴加0.5mL溴的四
氯化碳溶液或酸性KMnO4溶液,振荡静置,观察现象。
实验结论1:苯与不饱和烃有很大区别,苯分子中没
有双键。
实验结论2:苯分子中6个氢原子处于等同的地位。
设问:溶液是否褪色?
实验事实:苯的一溴代物(C6H5Br)只有一种结构,
根据以上事实可得出苯分子中有几种等效氢原子?
设问:苯分子中有没有双键?
实验结论1:苯与不饱和烃有很大区别,苯分子中没
有双键。
实验结论2:苯分子中6个氢原子处于等同的地位。
1.根据分子式推测出苯分子可能具有不饱和烃的结构;
探索过程归纳:
2.根据实验结论1,否定苯分子具有不饱和链烃的结构;
3.根据实验结论2,推测苯分子可能是环状结构。
设问:C6H6中6个H处于同等地位,6个C能否形成
直链?能否形成环状?
“梦的启示”
19世纪60年代,德国化学家凯库勒已经知道苯的分子式
为C6H6,但它们是如何排列、连接的呢?他提出多种可能
的排法,但经过推敲后都放弃了,他被这件工作弄得疲惫
不堪。一天,他搁下写满字的厚厚一叠纸便朦胧地睡了。
他在梦中看见6个碳原子组成了古怪的形状。6个碳原子组
成的“蛇”不断“弯弯曲曲地蠕动着”。突然这条蛇似乎
被什么东西所激怒,它狠狠地咬着自己的尾巴,后来牢牢
地衔在尾巴尖,就此不动了。凯库勒哆嗦一下,醒了过来。
多么奇怪的梦啊,总共只有一瞬间的梦,但是在他眼前的
原子和分子却没有消失,他记住了在梦中看见的分子中原
子的排列顺序,也许这就是答案吧?他匆匆地在纸上写下
了他所能够回想的一切,后来凯库勒提出了两点假设。
凯库勒假设的苯分子的结构:1.苯分子中的6
个碳原子形成平面六边形;2.苯环中的碳碳单键、
双键交替排列。
现代科学方法测得的苯分子结构:
空间构型:平面正六边形
(凯库勒式)
C
C
CC
C
C H
H
H
H
H
H
x xxx和 是同种物质
2.结构式和结构简式:
或
1.分子式:C6H6
㈠苯分子的结构
C
C
CC
C
C H
H
H
H
H
H
⑵碳碳键介于单键和双键之间的独特的键。
(既不是碳碳单键也不是碳碳双键)
⑴平面正六边形;
⒊分子结构:
㈡苯的物理性质
苯通常是无色、有特殊气味的液体,有毒、
不溶于水,密度比水小,熔点为5.5℃ ,沸点为
80.1℃。
㈢苯的化学性质
1、苯的氧化反应
2C6H6 + 15O2 12CO2 + 6H2O点燃
火焰明亮,有浓烟
2、苯的取代反应
⑴苯的溴代 反应条件:纯溴、催化剂
+ Br2 FeBr3
2、苯的取代反应
⑴苯的溴代 反应条件:纯溴、催化剂
+ Br2 FeBr3 Br+ HBr
⑴苯的溴代 反应条件:纯溴、催化剂
+ Br2 FeBr3 Br+ HBr
溴苯是无色液体,密度比水的大。
2、苯的取代反应(易)
( )
苯
液溴
( )
长导管
口处
( )
( )
( )
( )浓氨水
靠近
锥形
瓶内
滴入AgNO3溶液
烧瓶内
液体
倒入烧杯内水中
Fe屑
互溶、
不反
应、深
红棕色
剧烈
反应
白雾 白烟
淡黄色
沉淀
烧杯底部
有褐色油
状物、不
溶于水
实验小结:
实验思考题:
1.苯、溴、Fe屑等试剂加入烧瓶的顺序是怎样的?
2.Fe屑的作用是什么?
3.将Fe屑加入烧瓶后,烧瓶内有什么现象?这说明什么?
4.长导管的作用是什么?
5.为什么导管末端不插入液面下?
6.哪些现象说明发生了取代反应而不是加成反应?
7.纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样
使之恢复本来的面目?
苯 液溴 Fe屑
用作催化剂
剧烈反应,烧瓶中充满红棕色蒸气。反应放热。
用于导气和冷凝回流(或冷凝器)
溴化氢易溶于水,防止倒吸。
苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代
反应而非加成反应。因加成反应不会生成溴化氢。
因为未发生反应的溴溶解在生成的溴苯中。用水和碱
溶液反复洗涤可以使褐色褪去,还溴苯以本来的面目。
+ HNO3 浓硫酸
△
⑵苯的硝化
+ HNO3 浓硫酸
△
⑵苯的硝化
NO2+ H2O
硝基苯
3、苯的加成反应(难)
+ H2
催化剂
△
环己烷
3
“只与氢气加成”
各类烃的性质比较
烷烃 烯烃 苯
与
Br2
作用
Br2试剂
反应条件
反应类型
与酸
性
KMnO4
作用
点
燃
现象
结论
纯溴 溴水 纯溴
光照
取代 加成
催化剂
取代
现象
结
论
不褪色 褪色 不褪色
不被
酸性
KMnO4
溶液
氧化
易被
酸性
KMnO4
溶液
氧化
苯不被酸性
KMnO4溶液
氧化
火焰颜色
浅,无烟
火焰明亮,
有黑烟
火焰明亮,
有浓烟
含碳
量低
含碳量
较高 含碳量高
练习一
与Cl
Cl
Cl
Cl ____(是,不是)同一种物
质,理由是____________________________
是
苯环的碳碳键完全相同。
练习二
将溴水与苯充分混合振荡,静置后观察到的现
象是_________________________________
这种操作叫做_____。欲将此溶液分开,必须使
用到的仪器是________。将分离出的苯层置于一
试管中,加入某物质后可产生白雾,这种物质是
_____________,反应方程式是___________
溶液分层;上层显橙色,下层近无色
萃取
分液漏斗
FeBr3
+ Br2 FeBr3 Br+ HBr
㈣苯的用途及危害
室内环境中苯的来源主要是燃烧烟草的烟雾、溶剂、油漆、染
色剂、图文传真机、电脑终端机和打印机、粘合剂、墙纸、地毯、
合成纤维和清洁剂等。
短时间内吸入高浓度苯蒸汽可发生急性苯中毒,出现兴奋或
酒醉感,伴有黏膜刺激症状。轻则头晕、头痛、恶心、呕吐、步
态不稳;重则昏迷、抽搐及循环衰竭直至死亡;短期内吸入较高
浓度苯后可发生亚急性苯中毒,出现头昏、头痛、乏力、失眠、
月经紊乱等症状,并可发生再生障碍性贫血、急性白血病,表现
为迅速发展的贫血、出血、感染等。长期接触苯会对血液造成极
大伤害,引起慢性中毒。苯可以损害骨髓,使红血球、白细胞、
血小板数量减少,并使染色体畸变,从而导致白血病,甚至出现
再生障碍性贫血。苯可以导致大量出血,从而抑制免疫系统的功
用,使疾病有机可乘。有研究报告指出,苯在体内的潜伏期可长
达12-15年。
苯中毒对身体的危害归结为3种:致癌、致残、致畸胎。
㈤芳香烃 含有苯环的烃。
CH3
-CH3
-CH3
CH3
-CH3
CH3
CH3
甲苯 邻二甲苯 间二甲苯 对二甲苯
烃:仅由碳和氢两种元素组成的有机物。
㈠烃的分类
链烃
环烃
烷烃 CnH2n+2(n≥1)
CnH2n (n≥2)
CnH2n-2(n≥2)
烃
饱和链烃
不饱和链烃
芳香烃
烯烃
炔烃
知识总结
环烷烃 CnH2n (n≥3)
(含C≡C)
㈡各类烃的结构特点和主要化学性质
1.易取代(卤代、硝化)
2.较难加成(加 H2 )
3.氧化反应(燃烧)
1.加成反应(加H2、X2 、HX 、 H2O)
2.氧化反应[燃烧;被KMnO4(H+)氧化]
3.加聚反应
含有C=C键
1.稳定:通常情况下不与强酸、强碱、强
氧化剂反应
2.取代反应(卤代)
3.氧化反应(燃烧)
4.加热分解
仅含C-C单键
芳 香
烃
烯
烃
烷
烃
主 要 性 质结 构 特 点类别
含有苯环
( )
作业
写出以下化学方程式,并注明反应类型
⒈乙烯使溴的四氯化碳溶液褪色
⒉工业上用乙烯水化制乙醇
⒊聚乙烯的生成
⒋聚丙烯的生成
⒌苯与溴的反应
⒍苯与浓硝酸和浓硫酸混合液的反应
相关文档
- 八年级数学上册第十二章全等三角形2021-05-24 20:25:5723页
- 六年级下册语文教学课件-第27课我2021-05-24 20:18:0012页
- 西师大版二年级数学上册第六单元表2021-05-24 20:17:037页
- 西师大版二年级数学上册第一单元表2021-05-24 20:13:057页
- 部编版语文一年级下册教学课件美丽2021-05-24 20:12:113页
- 二年级数学上册教学课件-9的乘法口2021-05-24 20:00:3120页
- 人教版小学二年级上册数学教学课件2021-05-24 19:56:0329页
- 人教版五年级数学下册第5单元图形2021-05-24 19:55:1126页
- 人教版小学一年级上册数学教学课件2021-05-24 19:44:3516页
- 人教版七年级上册数学第四章几何图2021-05-24 19:40:5227页