- 2.53 MB
- 2024-04-28 发布
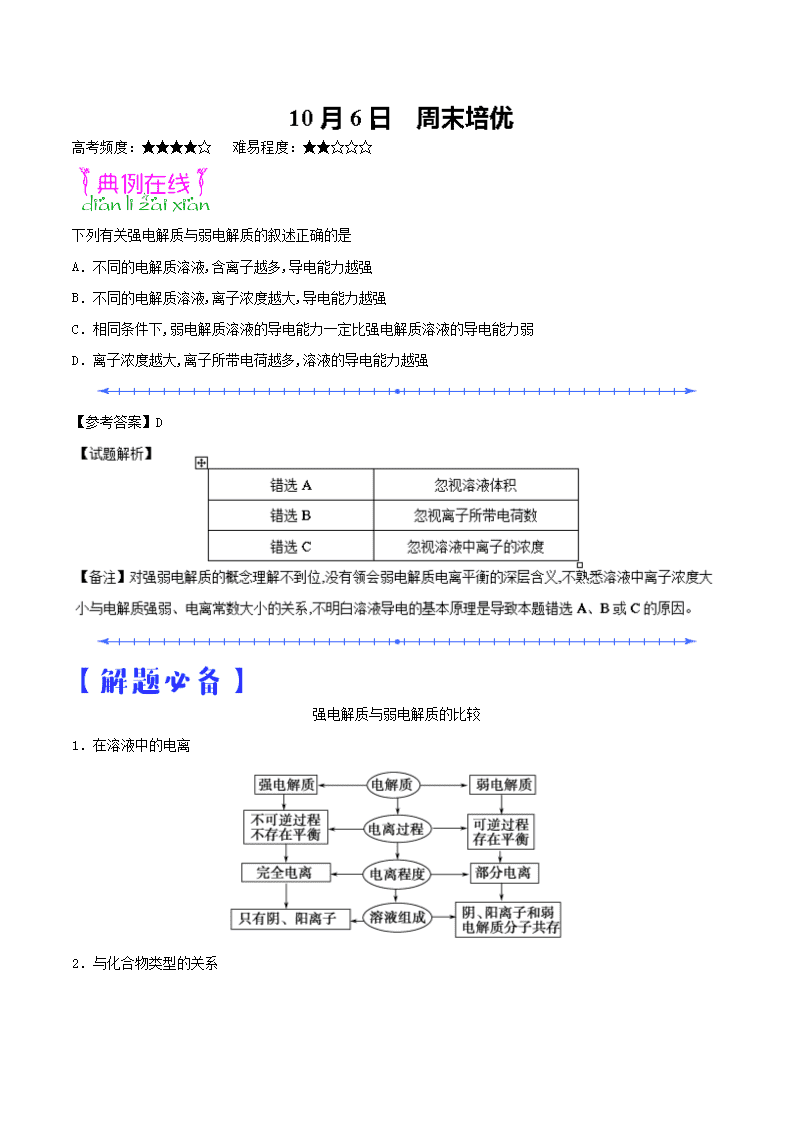
高考频度:★★★★☆ 难易程度:★★☆☆☆
下列有关强电解质与弱电解质的叙述正确的是
A.不同的电解质溶液,含离子越多,导电能力越强
B.不同的电解质溶液,离子浓度越大,导电能力越强
C.相同条件下,弱电解质溶液的导电能力一定比强电解质溶液的导电能力弱
D.离子浓度越大,离子所带电荷越多,溶液的导电能力越强【参考答案】D
强电解质与弱电解质的比较
1.在溶液中的电离
2.与化合物类型的关系
(1)电解质的强弱是由物质的内部结构决定的。强弱电解质的主要区别是在水溶液中能否完全电离。
(2)电解质的强弱与化学键没有必然联系。一般情况下,含有离子键的离子化合物是强电解质;含有强极性键的共价化合物可能是非电解质(如SO2、CH3CH2OH等)、弱电解质[如HF、HClO、HCN、H2CO3等弱酸,H2SO3、H3PO4两种中强酸,Fe(OH)3、Cu(OH)2、NH3·H2O等弱碱和H2O等]、强电解质(如HCl等)。
(3)电解质的强弱与溶液导电能力没有必然联系。溶液的导电性强弱取决于溶液中自由移动的离子的浓度和离子所带的电荷数。离子浓度越大、离子所带电荷数越多,溶液的导电性越强。在相同条件下(如温度、电解质的浓度等),强电解质溶液的导电能力比弱电解质强。
(4)电解质的强弱与电解质的溶解度无关。强电解质的溶解性不一定强,弱电解质的溶解性不一定弱。BaSO4是强电解质,但难溶于水;CH3COOH是弱电解质,但易溶于水。
1.强弱电解质的本质区别是
A.导电能力 B.相对分子质量
C.电离程度 D.溶解度
2.下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥氯化钠晶体 ⑦稀硫酸 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
3.(1)将等质量的锌粉分别投入10 mL 1 mol/L HCl和10 mL 1 mol/L的CH3COOH溶液中,①若锌不足量,反应速率快的是____________;②若锌过量,产生H2的量有何关系?____________.
(2)将等质量的锌粉分别投入c(H+)均为1 mol/L体积均为10 mL的盐酸和醋酸溶液中,①若锌不足量,反应速率快的是____________;②若锌过量,产生H2的量有何关系?____________.
1.【答案】C
2.【答案】①⑤⑦ ③⑤⑥ ⑨⑩ ②⑧
3.【答案】(1)盐酸与锌的反应 相等
(2)CH3COOH与锌的反应 CH3COOH与锌反应产生的氢气多
【解析】(1)盐酸是强酸,为强电解质,醋酸是弱酸,为弱电解质,两者均为一元酸,同物质的量浓度溶液中,盐酸中c(H+)大,故盐酸与锌反应的速率快;由于金属过量,酸全部都消耗掉,故两种酸产生H2的量相等。
(2)两种酸的c(H+)相等,则醋酸的物质的量浓度大,溶质的物质的量也大,开始时两者速率相同,但随着反应的进行,H+不断消耗,CH3COOH的电离平衡不断正向移动,不断电离出H+,故在反应进行的同一时刻,CH3COOH中的c(H+)大于盐酸中的c(H+),所以CH3COOH与Zn反应的速率快.当锌过量时CH3COOH与Zn反应产生的H2多。
你正走在学霸的路上!
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________