- 209.50 KB
- 2024-04-23 发布
第1课时 电解原理
[目标要求] 1.理解电解原理,初步掌握一般电解反应产物的判断方法。2.掌握电解电极反应方程式的书写。3.了解电解反应的一般规律。
一、电解
1.概念
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
2.特点
(1)电解是最强有力的氧化还原手段,是不可逆(填“可逆”或“不可逆”)的。
(2)电解质溶液的导电过程,就是电解质溶液的电解过程。
二、电解池
1.定义
把电能转化成化学能的装置。
2.形成条件
(1)直流电源;
(2)两个电极:与电源正极相连的一极是阳极;与电源负极相连的一极是阴极;
(3)电解质溶液或熔融电解质;
(4)形成闭合回路。
3.装置及电极反应
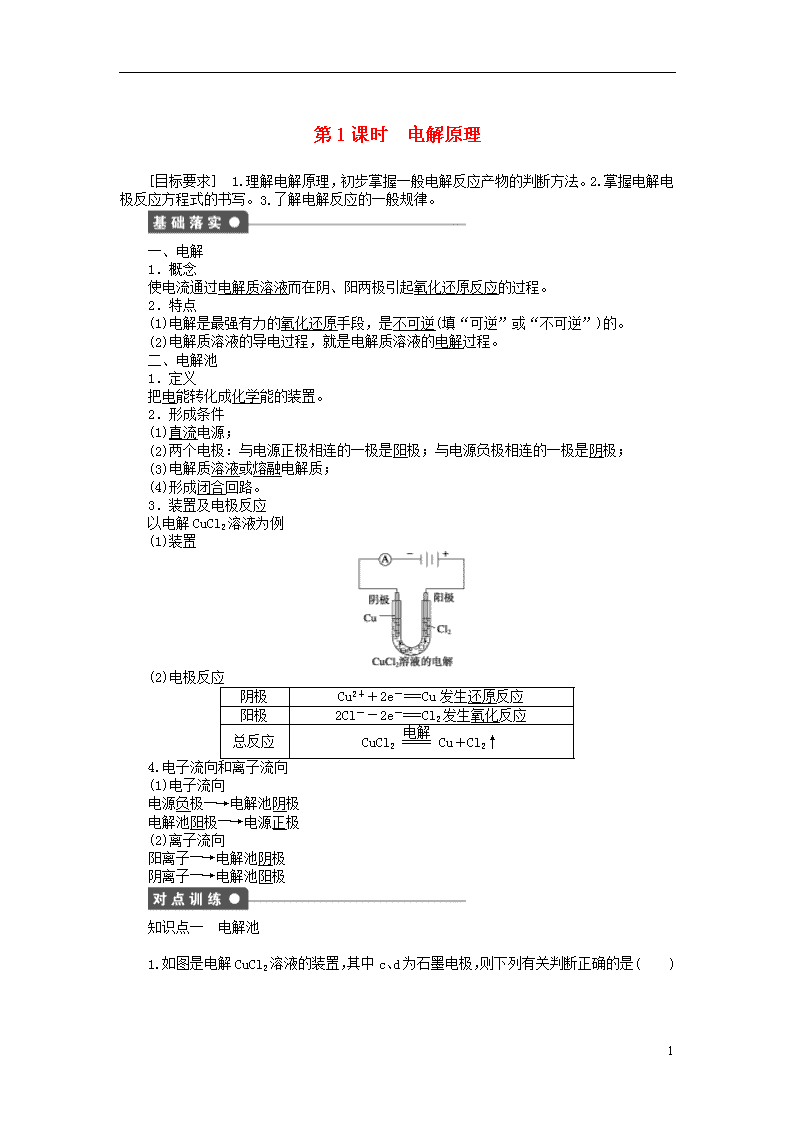
以电解CuCl2溶液为例
(1)装置
(2)电极反应
阴极
Cu2++2e-===Cu发生还原反应
阳极
2Cl--2e-===Cl2发生氧化反应
总反应
CuCl2Cu+Cl2↑
4.电子流向和离子流向
(1)电子流向
电源负极―→电解池阴极
电解池阳极―→电源正极
(2)离子流向
阳离子―→电解池阴极
阴离子―→电解池阳极
知识点一 电解池
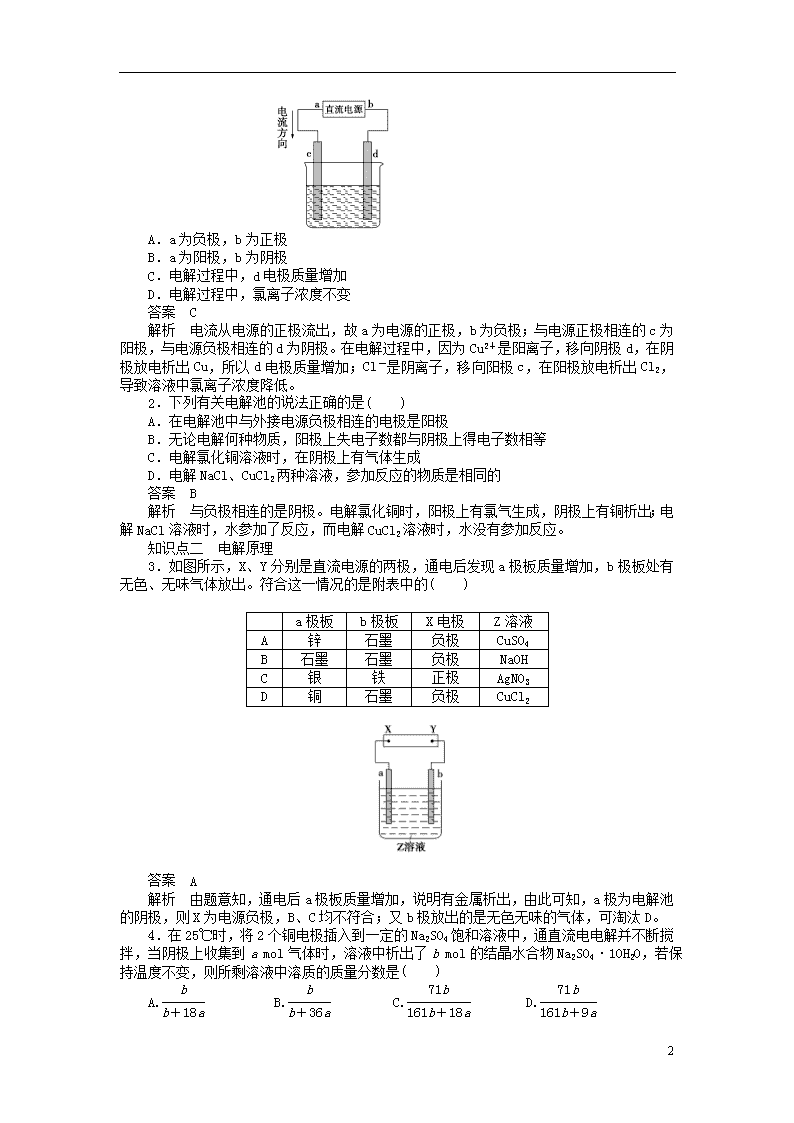
1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
6
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
答案 C
解析 电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d为阴极。在电解过程中,因为Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,导致溶液中氯离子浓度降低。
2.下列有关电解池的说法正确的是( )
A.在电解池中与外接电源负极相连的电极是阳极
B.无论电解何种物质,阳极上失电子数都与阴极上得电子数相等
C.电解氯化铜溶液时,在阴极上有气体生成
D.电解NaCl、CuCl2两种溶液,参加反应的物质是相同的
答案 B
解析 与负极相连的是阴极。电解氯化铜时,阳极上有氯气生成,阴极上有铜析出;电解NaCl溶液时,水参加了反应,而电解CuCl2溶液时,水没有参加反应。
知识点二 电解原理
3.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
答案 A
解析 由题意知,通电后a极板质量增加,说明有金属析出,由此可知,a极为电解池的阴极,则X为电源负极,B、C均不符合;又b极放出的是无色无味的气体,可淘汰D。
4.在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A. B. C. D.
6
答案 C
解析 电解发生的电极反应:阳极为Cu-2e===Cu2+,阴极为2H++2e===H2↑。电解时总的化学反应方程式为Cu+2H2OCu(OH)2↓+H2↑,阴极逸出a mol H2,水被电解了2a mol,根据溶解度知识,不难求出答案为C。如果将题中的铜电极换作铂电极,只改一个字,其电解的总反应方程式即为2H2O2H2↑+O2↑,阴极逸出a mol H2,水被电解了a mol。可见因一字之差(“铜”与“铂”),答案各异。由此再次强调提高审题的准确性是多么的必要。
知识点三 电解规律应用
5.用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),能使溶液恢复到原来的成分和浓度的是( )
A.AgNO3[AgNO3] B.NaOH[H2O]
C.KCl[KCl] D.CuSO4[Cu(OH)2]
答案 B
解析 A项:4AgNO3+2H2O4Ag+O2↑+4HNO3脱离反应体系的物质是4Ag+O2,相当于2Ag2O,所以应当加入适量Ag2O才能复原。(加入AgNO3,会使NO的量增加);B项:2H2O2H2↑+O2↑ 脱离反应体系的是2H2+O2,相当于2H2O,加入适量水可以复原。C项:2KCl+2H2O2KOH+H2↑+Cl2↑ 脱离反应体系的是H2+Cl2,相当于2HCl,应通入适量HCl气体才能复原。(加入盐酸时,同时也增加了水) D项:2CuSO4+2H2O2H2SO4+2Cu+O2↑ 脱离反应体系的是2Cu+O2,相当于2CuO,加入适量CuO可以复原。
6.用铂作电极电解某种溶液,通电一段时间后,溶液的pH变小,并且在阳极得到0.56 L气体,阴极得到1.12 L气体(两种气体均在相同条件下测定)。由此可知溶液可能是( )
A.稀盐酸 B.KNO3溶液 C.CuSO4溶液 D.稀硫酸
答案 D
解析 阳极与阴极产生的气体体积比为=,相当于电解水,pH变小说明电解了含氧酸。
练基础落实
1.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
答案 B
解析 此题将电解知识与原电池知识融合在一起。要解决此问题,必须要从概念、模型、电极名称、电极反应式等方面去区分,这些知识都弄清楚了,才能顺利解答此题,达到“在应用中理解、在理解中应用”的效果。左图为电解池,Fe为阳极,阳极反应式为Fe-2e-===Fe2+;Zn为阴极,阴极反应式为2H++2e-===H2↑,因此Ⅰ区域c(OH-)变大,碱性增强使酚酞变红;右图为原电池,Fe为正极,正极反应式为2H2O+O2+4e-===4OH-,因此Ⅳ区域c(OH-)变大,碱性增强使酚酞变红。
6
2.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
答案 D
解析 电解稀H2SO4,其实质是电解水,因溶剂减少,H2SO4浓度将增大,故溶液的pH变小;电解稀NaOH溶液,虽然OH-在阳极放电,但H+同时也在阴极放电,其实质同样是电解水,溶液的浓度也将变大,故溶液的pH变大;电解Na2SO4溶液,其实质也是电解水,在阴极和阳极分别析出H2和O2,二者的物质的量之比为2∶1,而非1∶2;电解CuCl2溶液,在阴、阳两极上分别析出Cu和Cl2,二者的物质的量之比为1∶1。
3.电解CuCl2与NaCl的混合溶液,阴极上和阳极上最先析出的物质为( )
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
答案 B
解析 溶液中Cu2+、H+、Na+移向阴极,Cu2+先放电得到Cu;Cl-、OH-移向阳极,Cl-先放电得到Cl2。
4.在水中加等物质的量的Ag+、Pb2+、Na+、SO、NO、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
答案 C
解析 溶液中的六种离子,有四种发生反应生成沉淀,Ag++Cl-===AgCl↓、Pb2++SO===PbSO4↓,最后溶液就成了NaNO3溶液;而电解NaNO3溶液,实质上就是电解水,电解方程式为2H2O2H2↑+O2↑。氧化产物和还原产物的质量之比为m(O2)∶m(H2)=(1 mol×32 g·mol-1)∶(2 mol×2 g·mol-1)=8∶1,即C项正确。
5.下列说法正确的是( )
①电解是把电能转变成化学能的过程 ②电解是化学能转变成电能的过程 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
答案 D
解析 从能量角度看,电解是把电能转变成化学能的过程,故①对、②错;电解质溶液的导电过程,必将伴随着两个电极上氧化还原反应的发生,同时生成新的物质,故③、⑤对;某些不能自发进行的氧化还原反应,通过电解的原理供给电能也可以实现,故④对。所以D选项符合题意。
练方法技巧
6.在100 mL H2SO4和CuSO4的混合溶液中,用石墨作电极进行电解,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
答案 A
解析 两极均收集到气体时,阴极是Cu2+放电后,H+又放电生成氢气;阳极是OH-放电生成氧气。n(H2)=n(O2)=2.24 L/22.4 L·mol-1=0.1 mol,由电子守恒得n(Cu2+)×2+
n(H2)×2=n(O2)×4,即:c(Cu2+)×0.1 L×2+0.1 mol×2=0.1 mol×4,解得:c(Cu2+)=1 mol·L-1。本题考查阳离子在阴极的放电顺序:Cu2+>H+。
7.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
答案 D
6
解析 由电解CuSO4溶液的反应的化学方程式2CuSO4+2H2O2Cu+O2↑+2H2SO4知,电解过程中只析出Cu和放出O2,故电解后加入CuO就可以复原。但本题提示加入0.1 mol Cu(OH)2可以复原,说明电解过程中不仅有CuSO4被电解,还有H2O被电解。0.1 mol Cu(OH)2相当于0.1 mol CuO和0.1 mol H2O,由电子守恒0.1 mol CuO~0.1 mol Cu~0.2 mol e-,0.1 mol H2O~0.1 mol H2~0.2 mol e-,共计0.4 mol e-。
8.铅蓄电池的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O。研读下图,下列判断不正确的是( )
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
答案 C
解析 当K闭合时,装置Ⅰ中的电极为Pb和PbO2,应为原电池,b极(Pb)作负极,a极(PbO2)作正极;Ⅱ中的电极均为PbSO4,应为电解池,c极为阴极,d极为阳极。A项:K闭合时,d极发生氧化反应:PbSO4+2H2O-2e-===PbO2+4H++SO,正确;B项:电路中转移0.2 mol电子时,Ⅰ中消耗0.2 mol H2SO4和0.1 mol Pb,正确;C项:Ⅱ中SO向阳极(d极)迁移,错误;D项:K闭合一段时间后,c极表面生成Pb,d极表面生成PbO2,装置Ⅱ可单独作为原电池,d电极为正极,正确。
练综合拓展
9.在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是
________________________________________________________________________
________________________________________________________________________。
(1) 若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是
________________________________________________________________________
________________________________________________________________________。
答案 (1)不变 (2)Zn-2e-===Zn2+ (3)1.28 Cu2++2e-===Cu
解析 (1)两极均为铜片,电解液为CuSO4溶液,这是一个电镀装置,电解过程中电解质溶液的浓度不变。
(2)阳极为纯锌,为活泼金属,通电电解时,锌发生氧化反应:Zn-2e-===Zn2+。
(3)若阳极为纯锌,阴极为铜片,不考虑H+在阴极上放电,则阴极反应为Cu2+得电子的还原反应:Cu2++2e-===Cu。当电路中有0.04 mol电子通过时,有0.04 mol/2×64 g·mol-1=1.28 g铜析出。
10.下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL (标准状况)气体。回答:
6
(1)直流电源中,M为__________极。
(2)Pt电极上生成的物质是________,其质量为__________________________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶______∶______∶________。
(4)AgNO3溶液的浓度________(填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH______,硫酸的浓度___________________________________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
答案 (1)正 (2)Ag 2.16 (3)2 1 (4)不变 不变 增大 减小 (5)45.18
解析 电解5.00%的稀硫酸溶液,实际上是电解其中的水。因此在该电解池中发生反应:2H2O2H2↑+O2↑,V(H2)∶V(O2)=2∶1。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336 mL气体中,V(H2)=×336 mL=224 mL,为0.01 mol;V(O2)=×336 mL=112 mL,为0.005 mol。说明电路上有0.02 mol电子,因此在b极(Pt、阴极)产生Ag:0.02 mol×108 g·mol-1=2.16 g,即0.02 mol的Ag。则n(e-)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶∶1。由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电解池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+的物质的量等于Ag电极被还原给溶液补充的Ag+的物质的量,因此AgNO3溶液的浓度不变,溶液的pH也不变。电解5.00%的稀硫酸溶液时,由于其中的水发生电解,因此硫酸的浓度增大,H+的浓度增大,故溶液的pH减小。设原5.00%的硫酸为x g,电解时消耗水0.01 mol×18 g·mol-1=0.18 g,则5.00%x=5.02%(x-0.18),解得x=45.18 g。
6