- 223.00 KB
- 2024-04-11 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
眉山中学2019届高二12月月考试题
理综化学
相对原子质量:Pb 207 K 39 C 12 N 14 O 16 H 1 Fe 56
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜做阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网做阴极
D.在镀件上电镀铜,用铜做阳极
2. 下列解释实际应用的原理表达式中,不正确的是( )
A. 用排饱和食盐水法收集Cl2:Cl2+H2OH++Cl-+HClO
B. 热的纯碱溶液碱性增强:CO32-+2H2OH2CO3+2OH- △H>0
C. 向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+
D. 用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)TiO2·x H2O↓+4HCl
3.25oC时,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是( )
加入的物质
结论
A
50mL 1mol/L H2SO4
反应结束后,c (Na+) = c(SO42-)
B
0.05mol CaO
若反应完全后溶液的体积仍为100mL,则溶液的pH约为14
C
50mL H2O
c (Na+) = 2[c (CO32-) + c (HCO3-)]
D
0.1 mol NaHSO4
反应完全后,溶液pH减小,c (Na+)不变
4. 常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是 ( )
A. 过滤后的溶液中一定没有S2-。
B. MnS难溶于水,可溶于MnCl2溶液中
C. 常温时,CuS、PbS、CdS比MnS更难溶
D. 加入MnS后生成CuS的离子方程式是Cu2++S2-=CuS↓
5.
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。下列有关说法不正确的是 ( )
A. 放电时,电子由Ca电极流出
B. 放电过程中,Li+向PbSO4电极移动
C. 正极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
D. 每转移0.1mol电子,理论上生成20.7 g Pb
6. 下列说法正确的是( )
A. 常温下,0.2mol/L的醋酸和pH=13的NaOH溶液等体积混合后呈酸性,
C(CH3COOH)+2C(OH-)=C(CH3COO-)+2C(H+)
B. 1 mL浓氨水加水稀释至100 mL后,溶液中n(OH-)减少
C.等浓度的NaHCO3溶液和碳酸钠溶液混合,所得溶液中
3C(Na+)=2C(HCO3-)+2C(CO32-)+2C(H2CO3)
D. 0.001mol/L的CH3COOH(Ka=1x10-5)溶液的pH约为4
7.某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是( )
A.A为电源正极
B.阴极区附近溶液pH升高
C.阳极区溶液中发生的氧化还原反应为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收集到H213.44 L时,有0.1 mol Cr2O72-被还原
8. (16分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液
c. 加水稀释 d. 加入少量醋酸钠晶体
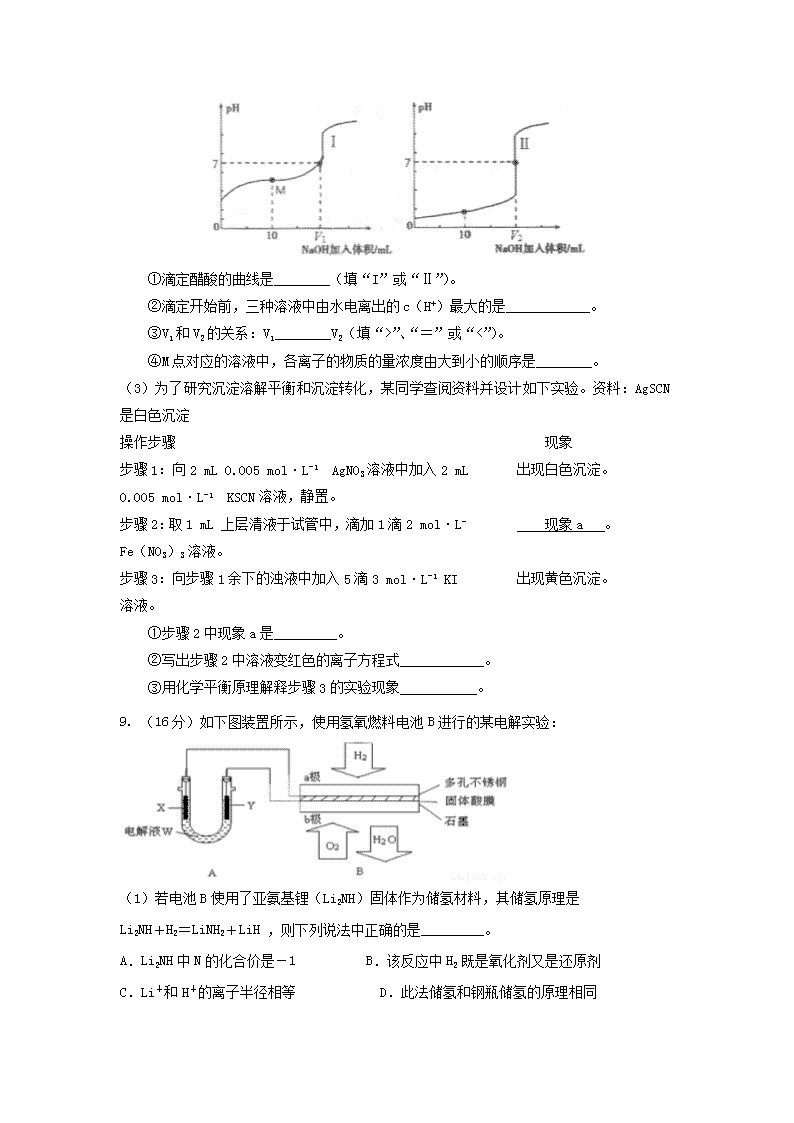
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是____________。
③V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤
现象
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。
出现白色沉淀。
步骤2:取1 mL 上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。
现象a 。
步骤3:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。
出现黄色沉淀。
①步骤2中现象a是_________。
②写出步骤2中溶液变红色的离子方程式____________。
③用化学平衡原理解释步骤3的实验现象___________。
9. (16分)如下图装置所示,使用氢氧燃料电池B进行的某电解实验:
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是_________。
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则H+向______极移动。(填“a”或“b ”)
② b极上的电极反应式为:__________________________________________________
③ 外电路中,每转移0.1 mol电子,在a极消耗_______L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是_______。在X极这边观察到的现象是_______。
② 检验Y电极上反应产物的方法是_______。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是_______。
10. (14分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1) I中NH3和O2在催化剂作用下反应,其化学方程式是____________________________
(2)II中,2NO(g) +O2(g) 2NO2(g) 。在其他条件相同时,
分别测得NO的平衡转化率在不同压强(p1、p2)下温度
变化的曲线(如右图)。
①比较p1、p2的大小关系_____________
②随温度升高,该反应平衡常数变化的趋势是__________
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g) ΔH1
2NO2(g) N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)____________
A B C
②N2O4与O2、H2O化合的化学方程式__________________________________________
(4)IV中,电解NO制备NH4NO3,其工作原理如右图,
为使电解产物全部转化为NH4NO3,需补充物质A,
A是________,说明理由:______________________
______________________________________________
11.(12分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_________________________________ _____________________________________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=_________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为
4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为____________________________________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全__________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
化学月考答案
7. A 8. B 9.B 10. C 11. D 12.D 13.D
26. (1)①bc
(2)①I ②CH3COOH ③< ④c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(3)①溶液变红 ②Fe3++3SCN-Fe(SCN)3
③浊液中存在沉淀溶解平衡AgSCN(s)Ag+(aq)+SCN-(aq),加入碘离子,生成溶解度更小的AgI沉淀,降低了银离子浓度,使平衡正向移动,白色沉淀转化为黄色的碘化银沉淀。
27. (1)B (2)①b ② O2 + 4H+ + 4e- = 2H2O ③ 1.12
(3)① 2H++2e- = H2↑,溶液变红
②用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气 ③ 制Fe(OH)2
28.(1)4NH3+5O2 4NO+6H2O
(2)①p1 10-5(a-0.01)
(4)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(5)c(Fe3+)==1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全