- 281.00 KB
- 2024-03-12 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
2018-2019学年江西省南昌市第二中学高一下学期第一次月考化学试题
相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64 Na-23 Ca-40
一、选择题(共48分,每小题只有1个选项符合题意)
1.以下性质的比较中,错误的是
A.酸性:H2CO3>H2SiO3>Al(OH)3
B.熔、沸点:K>Na >Li
C.热稳定性:HF>HCl>H2S
D.碱性:KOH>NaOH>Mg(OH)2
2.已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-<D-
3.下列组合不能实现喷泉实验的是
A.NO和水 B.CO2和NaOH溶液 C.HCl和水 D.Cl2和NaOH溶液
4.铜有两种天然同位素Cu 和Cu ,参考铜的相对原子质量(63.5),估算Cu的原子个数百分含量约是
A.20% B.25% C.50% D.75%
5.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应剧烈程度,两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
6.某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数是( )
A. 只有x+1
B. 可能是x+8或x+18
C. 可能是x+2
D. 可能是x+1或x+11或x+25
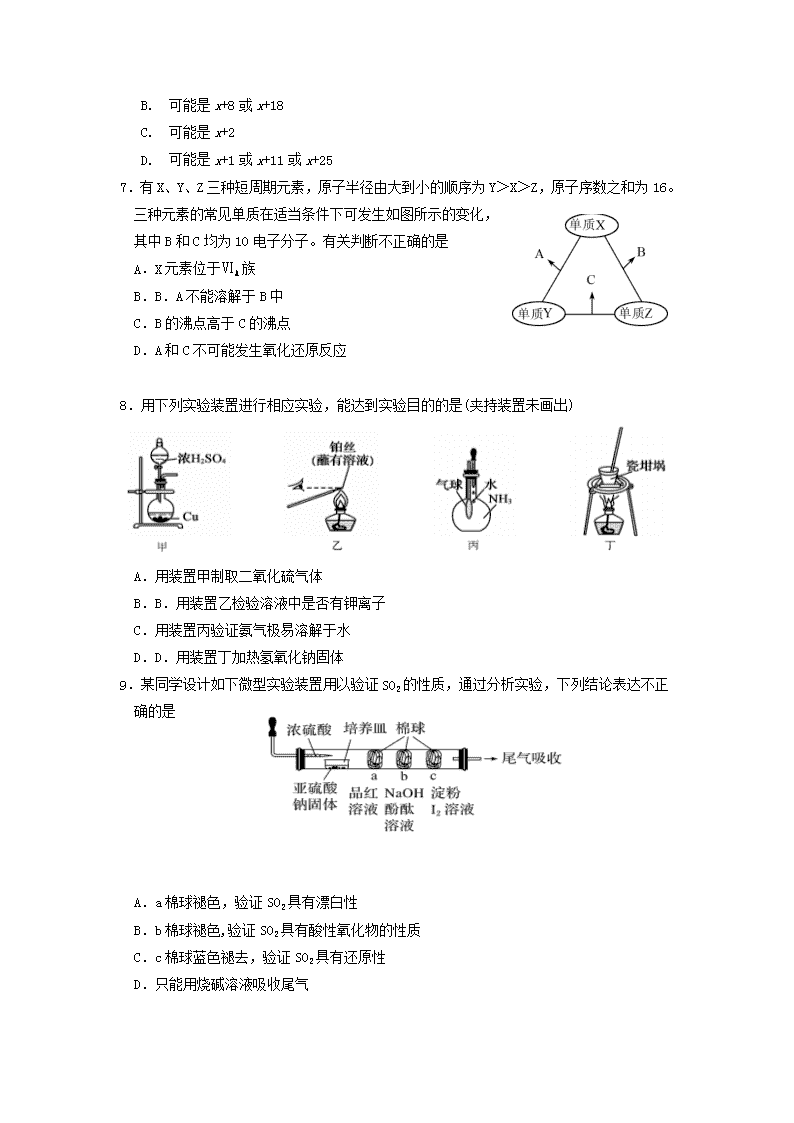
7.有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。
三种元素的常见单质在适当条件下可发生如图所示的变化,
其中B和C均为10电子分子。有关判断不正确的是
A. X元素位于ⅥA族
B. B.A不能溶解于B中
C.B的沸点高于C的沸点
D.A和C不可能发生氧化还原反应
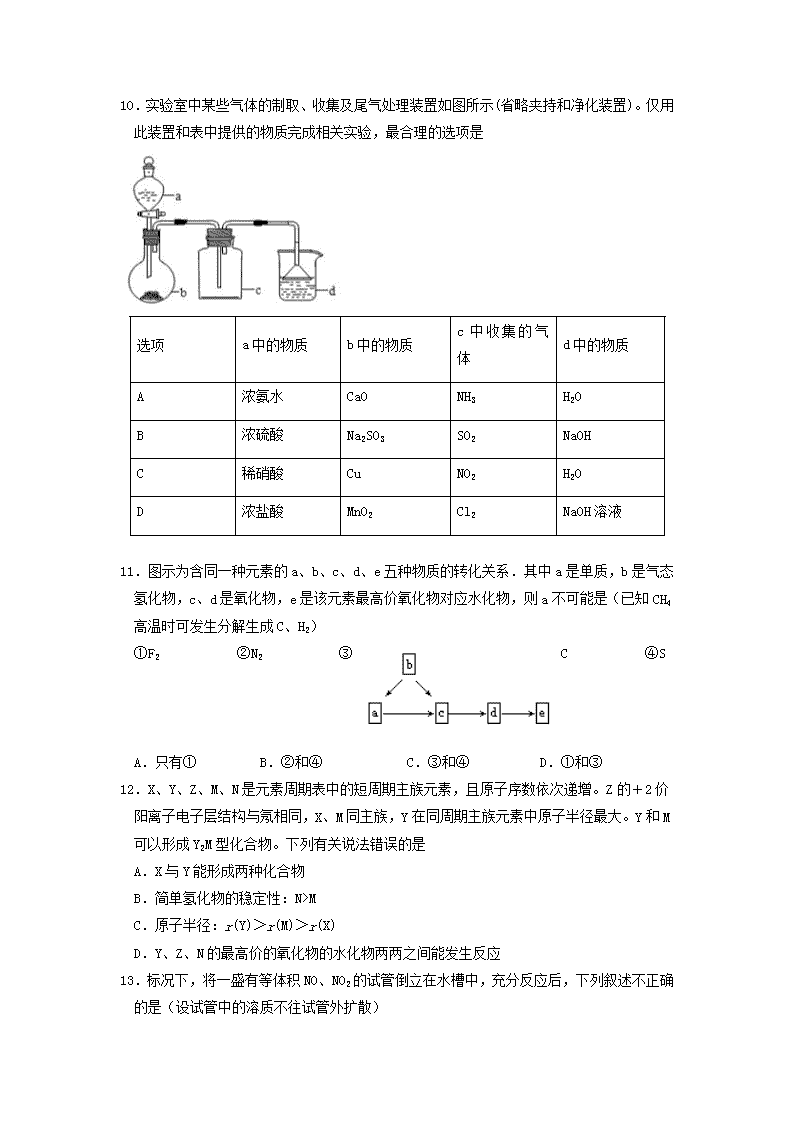
8.用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
A. 用装置甲制取二氧化硫气体
B. B.用装置乙检验溶液中是否有钾离子
C. 用装置丙验证氨气极易溶解于水
D. D.用装置丁加热氢氧化钠固体
9.某同学设计如下微型实验装置用以验证SO2的性质,通过分析实验,下列结论表达不正确的是
A.a棉球褪色,验证SO2具有漂白性
B.b棉球褪色,验证SO2具有酸性氧化物的性质
C.c棉球蓝色褪去,验证SO2具有还原性
D.只能用烧碱溶液吸收尾气
10.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
11.图示为含同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应水化物,则a不可能是(已知CH4高温时可发生分解生成C、H2)
①F2 ②N2 ③C ④S
A.只有① B.②和④ C.③和④ D.①和③
12.X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。Z的+2价阳离子电子层结构与氖相同,X、M同主族,Y在同周期主族元素中原子半径最大。Y和M可以形成Y2M型化合物。下列有关说法错误的是
A.X与Y能形成两种化合物
B.简单氢化物的稳定性:N>M
C.原子半径:r(Y)>r(M)>r(X)
D.Y、Z、N的最高价的氧化物的水化物两两之间能发生反应
13.标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A.此反应中水既不是氧化剂又不是还原剂
B.试管内溶液中溶质的物质的量浓度为
C.溶液体积占试管容积的三分之二
D.若将试管中的气体换为氯化氢或者氨气,则水充满试管
14.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②③④ B.②③④⑤ C.①③④ D.①②③④
15.在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
16.将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为
A.n(SO2)/n(H2)=1/1 B.n(SO2)/n(H2)=4/1
C.n(SO2)/n(H2)=1/4 D.n(SO2 )/n(H2)=3/2
二、填空题(共52分)
17.(8分)(1)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:A.脱水性 B.酸性 C.强氧化性 D.吸水性
①在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 (_______)
②Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 (_______)
③向滤纸上滴加浓H2SO4 ,滤纸变黑。 (_______)
④在冷浓H2SO4中放入铁片没明显现象 (_______)
(2)①有H、D、T 三种原子,在标况下,它们的单质的密度之比是 ,在标况下,1L各单质中,它们的电子数之比 。
②水和重水分别跟金属钾反应,若两反应中电子转移总数相等时,消耗水和重水的质量比 ;生成气体的质量比 。
18.(10分)X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的分子式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成18电子分子,分子式为_________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中酸性明显不同于其他三种酸的是_______(用酸的分子式表示)。
19.(10分)硫酸是化工行业广泛应用的基础原料,某化学兴趣小组为探究浓硫酸所具有的一些特殊性质,进行如下有关实验。
实验一:浓硫酸与铜反应
(1)装置A中发生反应的化学方程式为_____________________________;当反应转移0.2mol电子时,生成气体在标况下的体积为 L。
(2)装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是______________;
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是________________,B中应放置的溶液是________。
A.水 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
实验二:浓硫酸与碳反应,并验证反应生成的气体产物
(4)冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A——________________________________________——B;
能说明气体产物中有CO2的实验现象是①__________________②____________________。
20 (14分).氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:
①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2(CaSO4·2H2O)碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂
Ca(OH)2
NaOH
价格(元/kg)
0.36
2.9
和石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(2)石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。
上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
(3)一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
21.(10分)一定量铜与100mL cmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。
回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式______________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是__________________________。
高一化学试题参考答案
一、选择题(共48分,每小题只有1个选项符合题意)
1
2
3
4
5
6
7
8
B
B
A
D
B
D
D
C
9
10
11
12
13
14
15
16
D
B
A
D
C
D
C
A
二、填空题
17.(8分)(1)D B A C (2)①1∶2∶3, 1∶1∶1,②9:10 1∶2
18.(10分)(1) (2)CO2 (3) N2H4 (2分)
(4)Cl2+SO2+2H2O=4H++SO42-+2Cl-(2分) (5)NCl3+3H2O=3HClO+NH3↑(2分) (6) H2CO3
19.(10分)(1)2H2SO4(浓)+CuCuSO4+SO2↑+2H2O(2分) 2.24 (2) 吸收多余的SO2 (3)溶液倒流回长颈漏斗中 D (4) 除去CO2中的SO2 (5)CDFECD ①第二个丙装置不褪色 ②乙中生成白色沉淀
20 (14分) (1)SO2+2NaOH=Na2SO3+H2O 成本较高
(2)NaOH CaO+H2O=Ca(OH)2 Ca(OH)2+Na2SO3=CaSO3↓+2NaOH
(3)6NO2+8NH37N2+12H2O (4)①(m+n)/V ②3∶2
21.(10分)(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2)0.05 (3)0.5
(4)2.5 (5)2NO+2NaOH+3H2O2=2NaNO3+4H2O