- 196.50 KB
- 2024-03-10 发布
福建省莆田市第二十四中学2018-2019学年高二上学期开学考试化学试题
时间:90分钟 分值:100分
相对原子质量: H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 P—31 一、选择题(本题共20道小题,每题3分,共60分,每题只有一个选择最符合题意)
1.一定条件下,在一恒容密闭容器中,下列能表示反应:X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是
①X、Y、Z 的物质的量之比为 1:2:2;②Y 的消耗速率与 Z 的消耗速率相等;③容器中的压强不再发生变化;④单位时间内生成 n mol Z 的同时消耗 nmol Y
A. ①② B. ①④ C. ③④ D. ②③
2.根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
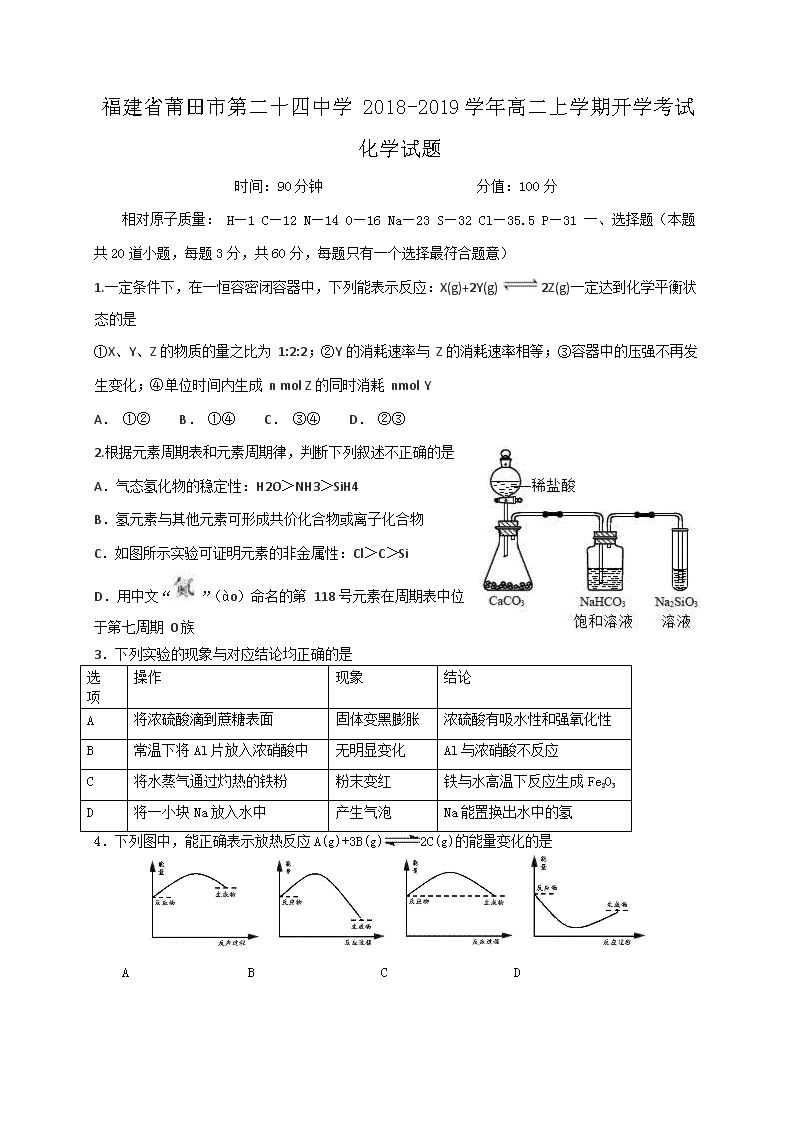
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第 118 号元素在周期表中位
于第七周期 0 族
3.下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有吸水性和强氧化性
B
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
将水蒸气通过灼热的铁粉
粉末变红
铁与水高温下反应生成Fe2O3
D
将一小块Na放入水中[]
产生气泡
Na能置换出水中的氢
4.下列图中,能正确表示放热反应A(g)+3B(g)2C(g)的能量变化的是
A B C D
5.某元素的离子结构示意图为,该元素在周期表中的位置是
A.第 5 周期零族 B.第 6 周期第ⅠB 族
C.第 5 周期第ⅦA 族 D.第 6 周期第ⅠA 族
6.同温同压下,等体积的两容器内分别充满由 14N、13C、18O 三种原子构成的一氧化氮和一氧化碳,
下列说法正确的是
A 所含分子数和质量均不相同
B 含有相同的分子数和电子数
C 含有相同的质子数和中子数
7.下列物质常温下见光不会分解....的是
D 含有相同数目的中子、原子和分子
A.HClO B.NH4Cl
C.浓 HNO3 D.AgNO3
8.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl溶于水
9.下列不能说明氯元素的非金属性比硫元素的强的有几项
①HCl比H2S稳定
②HClO的氧化性比H2SO4强 ③Cl2能与H2S反应生成S ④HCl
的溶解度比 H2S 大
⑤Cl2与 Fe 反应生成 FeCl3,S 与 Fe 生成 FeS ⑥HCl 的酸性比 H2S 强
A.1
B.2 C.3 D.4
10.下列关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.VIIA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
11.下列说法,可以表明反应N2 + 3H22NH3已达到平衡的标志是
A.1molN≡N键断裂的同时,有6molN-H键形成 B.1molN≡N键断裂的同时,有3molH-H键断裂 C.1molN≡N键断裂的同时,有3molH-H键形成
D.1molN≡N键断裂的同时,有2molN-H键断裂
12. 有 A、B、C、D 四种金属,当 A、B 组成原电池时,电子流动方向 A→B;当 A、D 组成原电池
时,A 为正极;B 与 C 构成原电池时,电极反应式为:C2﹣+2e﹣→C,B﹣2e﹣→B2+则 A、B、D、
E 金属性由强到弱的顺序为
A.A>B>C>D B.A>B>D>C
C.D>C>A>B
D.D>A>B>C
13.如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则
卡片上描述合理的是
①Cu 为负极,Zn 为正极
②Cu 极上有气泡产生,发生还原反应
③SO42﹣向 Cu 极移动
④若有 0.5mol 电子流经导线,则可产生 0.25mol 气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e﹣═Cu2+,发生氧化反应。
A.①②③ B.②④⑥ C.③④⑤ D.②④
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1molCl2与足量铁反应转移2NA个电子
B.常温常压下,32g氧气(O2)和32g臭氧(O3)都含有NA个氧原子
C.7.8g 过氧化钠与足量的水反应,转移的电子数为 0.2NA
D.通常状况下,22.4 L的氨气和甲烷含有的电子数均为10NA
15. 在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。下列说法正确的是
A. 所得胶体带正电 B. 将液体静置片刻,会出现沉淀现象
C. 用激光笔照射,会出现丁达尔现象 D. 可用滤纸分离提纯得到氢氧化铁胶体
16.具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是
A.原子序数关系:C>B>A B.C微粒是稀有气体元素的原子
C.微粒半径关系:Bn-