- 92.50 KB
- 2024-02-29 发布
石河子第二中学高二年级第一次月考试卷(化学)
一、选择题(每小题3分,共54分)
1. 下列措施不符合节能减排的是 ( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
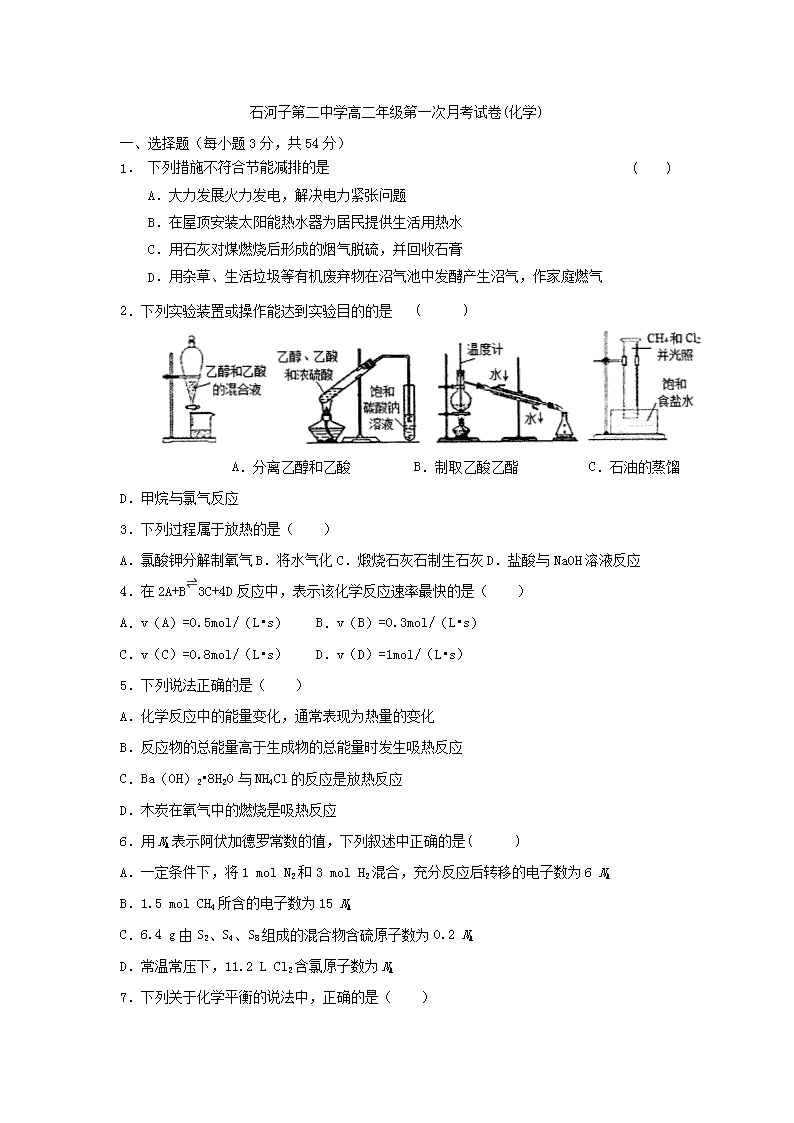
2.下列实验装置或操作能达到实验目的的是 ( )
A.分离乙醇和乙酸 B.制取乙酸乙酯 C.石油的蒸馏 D.甲烷与氯气反应
3.下列过程属于放热的是( )
A.氯酸钾分解制氧气B.将水气化C.煅烧石灰石制生石灰D.盐酸与NaOH溶液反应
4.在2A+B⇌3C+4D反应中,表示该化学反应速率最快的是( )
A.v(A)=0.5mol/(L•s) B.v(B)=0.3mol/(L•s)
C.v(C)=0.8mol/(L•s) D.v(D)=1mol/(L•s)
5.下列说法正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.Ba(OH)2•8H2O与NH4Cl的反应是放热反应
D.木炭在氧气中的燃烧是吸热反应
6.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA
B.1.5 mol CH4所含的电子数为15 NA
C.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
7.下列关于化学平衡的说法中,正确的是( )
A.当达到化学平衡时,反应物已完全转化为生成物
B.化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时,正逆反应均已停止
8.下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
9.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C.用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D.Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
10.下列反应过程中,△H>0且△S>0的是( )
A.NH3(g)+HCl(g)=NH4Cl(s) B.CaCO3(s)=CaO(s)+CO2(g)
C.4Al(s)+3O2(g)=2A12O3(s) D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)
11.根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
12.一定温度下,可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态标志的是( )
A.A、B、C的分子数之比为1:3:2
B.单位时间内生成amol N2,同时生成amolNH3
C.每断裂1molN≡N,同时断裂3molH﹣H
D.每生成1mol N≡N,同时生成6molN﹣H
13.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
14.反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
A.T1<T2,P1<P2 B.T1<T2,P1>P2 C.T1>T2,P1>P2 D.T1>T2,P1<P2
15.反应:A(气)+3B(气)⇌2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
16.已知:Fe2O3(s)+C(s)=CO2(g)+2Fe(s)△H=+234.1kJ•mol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是( )
A.﹣824.4kJ•mol﹣ B.﹣627.6kJ•mol﹣1 C.+744.7kJ•mol﹣1 D.﹣169.4kJ•mol﹣1
17.在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI⇌H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
A.该温度下,反应的平衡常数是
B.0~2min内的HI的平均反应速率为0.05mol•L﹣1•min﹣1
C.恒压下向该体系中加入N2,平衡不移动,反应速率不变
D.升高温度,平衡向正反应方向移动,只有正反应速率加快
18.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,下列分析中正确的是( )
A.图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B.图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
二、填空题(共46分)
19.(6分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)、反应开始到10s,用Z表示的反应速率 -----------------(2分)
(2)、反应开始到10s时,Y的转化率为------------------(2分)。
(3)、反应的化学方程式为:------------------(2分)。
20(10分).已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol
②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (2分)(填写序号)
(2)H2的燃烧热为 (2分)
(3)燃烧10g H2生成液态水,放出的热量为 (2分)
(4)C(s)的燃烧热的热化学方程式为 (2分)
(5)H2O(g)=H2O(l)△H= (2分)
21(8分).对于反应3X(g)+Y(g)═Z(g)△H〈0,在其他条件不变时,改变其中一个条件平衡是否移动(填“不移动”“向左”或“向右”):
(1)升高温度: ;(2分)(2)缩小容器的体积: (2分);
(3)体积不变的条件下,加入X: ;(2分)(4)加入催化剂: .(2分)
22.(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ
热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______________________________________.(3分)
(2)1 molN2(g) 与适量H2(g) 起反应生成NH3(g) ,放出92.2kJ热量______________________________________.(3分)
23.下表是稀硫酸与某金属反应的实验数据(8分):
实验
序号
金属质量
/g
金属
状态
c(H2SO4)
/mol•L﹣1
V(H2SO4)
/mL
金属消失
的时间/s
1
0.10
粉末
0.5
50
50
2
0.10
丝
0.8
50
200
3
0. 10
粉末
0.8
50
25
4
0.10
丝
1.0
50
125
分析上述数据,回答下列问题:
(1)实验1和3表明, (1分)对反应速率有影响,能表明这种影响因素的实验还有 (1分).(填实验序号)结论: _______________________.(2分)
(2)本实验中影响反应速率的其他因素还有 ,(1分)其实验序号是 ,(1分)结论 _______________________.(2分)
24.计算(8分)
在恒温恒压下,向体积为2 L密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。2min后,反应达到平衡,生成SO3为2mol。
求:(1)0~2 min内v(SO3)?(2分)
(2)平衡后容器中SO2的浓度?(3分)
(3)在此温度下该反应的平衡常数?(3分)
石河子第二中学高二年级第一次月考试卷(化学)
一、选择题(每小题3分,共54分)
题号
1
2
3
4
5
6
7
8
9
答案
A
D
D
B
A
B
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
B
A
D
B
C
C
A
B
C
二、填空题(共46分)
19.(6分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)、反应开始到10s,用Z表示的反应速率 0.079(2分)
(2)、反应开始到10s时,Y的转化率为-79%-(2分)。
(3)、反应的化学方程式为:X+Y=2Z(2分)。
20(10分).已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol
②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 1 4(2分)(填写序号)
(2)H2的燃烧热为 285 kJ/mol (2分)
(3)燃烧10g H2生成液态水,放出的热量为 1425 kJ (2分)
(4)C(s)的燃烧热的热化学方程式为 (2分)
(5)H2O(g)=H2O(l)△H= -86.4 kJ(2分)
21(8分).对于反应3X(g)+Y(g)═Z(g)△H〈0,在其他条件不变时,改变其中一个条件平衡是否移动(填“不移动”“向左”或“向右”):
(1)升高温度: 向左 ;(2分)(2)缩小容器的体积:向右 (2分);
(3)体积不变的条件下,加入X:向右 ;(2分)(4)加入催化剂: 不移动 .(2分)
22.(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______________________________________.(3分)
(2)1 molN2(g) 与适量H2(g) 起反应生成NH3(g) ,放出92.2kJ热量______________________________________.(3分)
23.下表是稀硫酸与某金属反应的实验数据(8分):
分析上述数据,回答下列问题:
(1)实验1和3表明, 浓度 (1分)对反应速率有影响,能表明这种影响因素的实验还有 2.4 (1分).(填实验序号)结论: ___浓度大,速率大____________________.(2分)
(2)本实验中影响反应速率的其他因素还有 接触面积 ,(1分)其实验序号是 2.3,(1分)结论 ____________面积大,速率大___________.(2分)
24.计算(8分)
在恒温恒压下,向体积为2 L密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。2min后,反应达到平衡,生成SO3为2mol。
求:(1)0~2 min内v(SO3)?(2分)0.5 mol/(L•min)
(2)平衡后容器中SO2的浓度?(3分)1 mol/L
(3)在此温度下该反应的平衡常数?(3分)4
您可能关注的文档
- 化学卷·2019届新疆石河子二中高二上学期第一次月考(2017
- 【数学】河北省秦皇岛市昌黎汇文二中2019-2020学年高一下学期期末考试试卷
- 年度工作总结-教师年度考核工作总结(小学)
- 【英语】2018届二轮复习动词(短语)典题50练之三学案(7页word版)
- 河南省新野县第一高级中学校2019-2020学年高二下学期第二次周考(理)数学试题
- 精选扶贫警示教育心得体会感悟【五篇】
- 【地理】陕西省延安市第一中学2019-2020学年高一下学期期中考试(解析版)
- 县委书记在全县党政领导干部生态环境保护专题培训班开班仪式上的讲话
- 2020公司财务总监个人述职报告3篇
- 2019届四川省成都外国语学校高三开学考试物理试题Word版含解析