- 245.15 KB
- 2024-02-28 发布
2018-2019学年重庆市南开中学
高二上学期第一次月考化学试题此卷只装订不密封
班级 姓名 准考证号 考场号 座位号
化学
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、单选题
1.人类将在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
2.下列与化学反应能量变化相关的叙述正确的是
A. 干冰气化需要吸收大量的热,这个变化是吸热反应
B. 反应物的总能量低于生成物的总能量时,发生放热反应
C. 化学反应中的能量变化都表现为热量的变化
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同
3.下列反应中,既属于氧化还原反应又属于吸热反应的是
A. Ba(0H)2•8H20与NH4Cl反应 B. 工业合成氨
C. 灼热的炭与CO2反应 D. 葡荀糖在人体内生理氧化
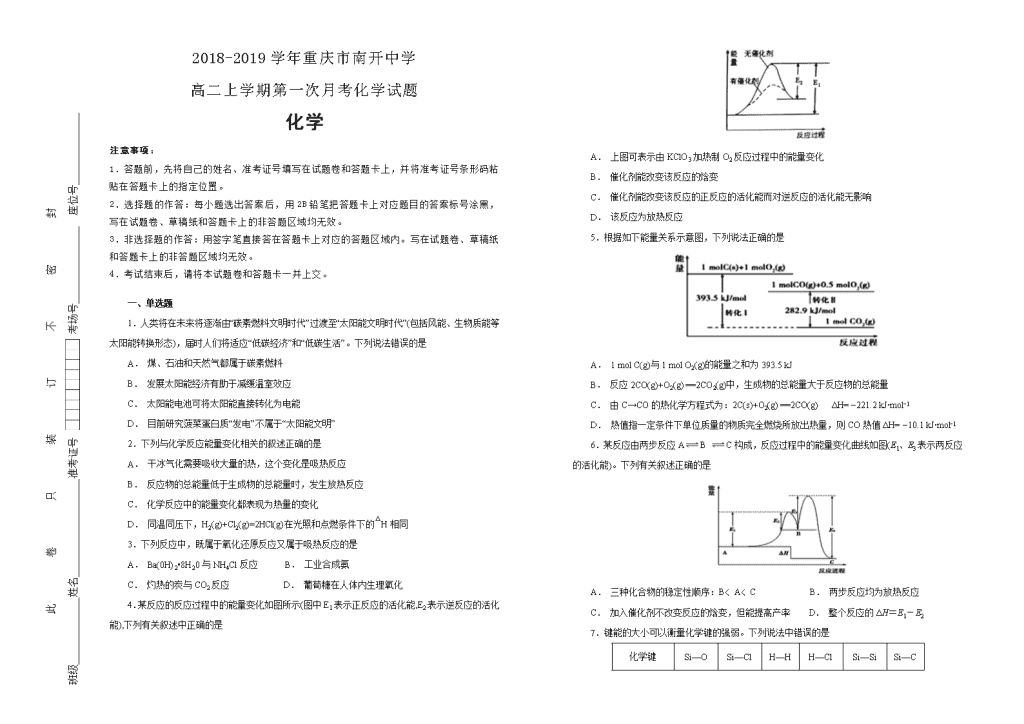
4.某反应的反应过程中的能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列有关叙述中正确的是
A. 上图可表示由KClO3加热制O2反应过程中的能量变化
B. 催化剂能改变该反应的焓变
C. 催化剂能改变该反应的正反应的活化能而对逆反应的活化能无影响
D. 该反应为放热反应
5.根据如下能量关系示意图,下列说法正确的是
A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= −221.2 kJ∙mol−1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= −10.1 kJ∙mol−1
6.某反应由两步反应AB C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是
A. 三种化合物的稳定性顺序:B﹤A﹤C B. 两步反应均为放热反应
C. 加入催化剂不改变反应的焓变,但能提高产率 D. 整个反应的ΔH=E1-E2
7.键能的大小可以衡量化学键的强弱。下列说法中错误的是
化学键
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能/kJ·mol-1
460
360
436
431
176
347
A. C—C的键能大于Si—Si
B. HCl的稳定性比HI稳定性高
C. SiCl4的熔点比SiC熔点低
D. 拆开1 mol四氯化硅中的化学键所吸收的能量为360 kJ
8.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
9.已知:2H2(g)+O2(g)2H2O(g) △H1
3H2(g)+Fe2O3(s)2Fe(s)+3H2O(g) △H2
2Fe(s)+32O2(g)Fe2O3(s) △H3
2Al(s)+32O2(g)Al2O3(s) △H4
2Al(s)+Fe2O3(s)A12O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1<0,△H3>0 B. △H5<0,△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
10.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:,判断下列说法正确的是
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
11.选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) △H1=a kJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)3N2(g)+6H2O(g) △H2=b kJ·mol-1
副反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H4=d kJ·mol-1
可以计算出反应2NO(g)+O2(g)2NO2(g)的△H为
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
12.在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A. SO2(g)+1/2O2(g)SO3(g) ΔH=-98.3kJ·mol-1
B. 2SO2(g)+O2(g) 2SO3(l) ΔH=-196.6kJ·mol-1
C. SO2(g)+1/2O2(g)SO3(g) ΔH=-78.64kJ·mol-1
D. 2SO2(g)+O2(g)2SO3(g) ΔH=+196.6kJ·mol-1
13.强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1。稀醋酸、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
A. A表示稀硝酸与NaOH溶液的反应
B. B表示稀醋酸与NaOH溶液的反应
C. b=5.73
D. C表示浓硫酸与NaOH溶液的反应
14.向足量H2SO4溶液中加入100mL0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL0.4mol·L-1HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A. Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-2.92kJ·mol-1
B. Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-0.72kJ·mol-1
C. Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-73kJ·mol-1
D. Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-18kJ·mol-1
15.下列关于反应热的描述中正确的是
A. CO(g)的燃烧热283.0kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1
B. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C. 反应热有正负之分,燃烧热ΔH全部是正值
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
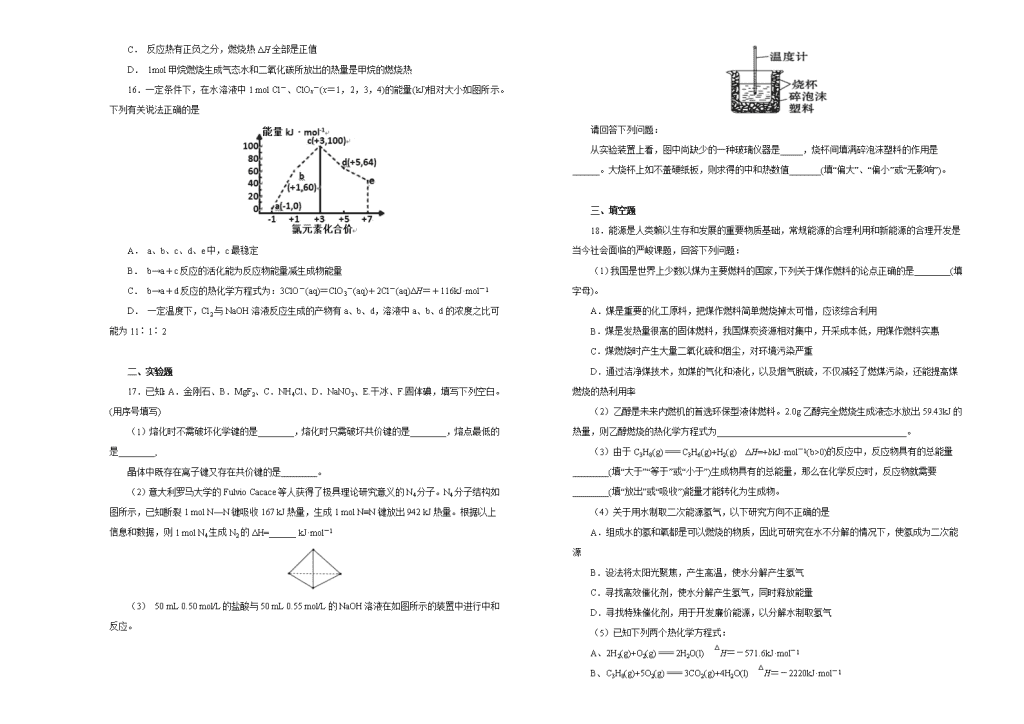
16.一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
二、实验题
17.已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
三、填空题
18.能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则乙醇燃烧的热化学方程式为__________________________________________。
(3)由于C3H8(g)C3H6(g)+H2(g) ΔH=+bkJ·mol-1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g)2H2O(l) △H=-571.6kJ·mol-1
B、C3H8(g)+5O2(g)3CO2(g)+4H2O(l) △H=-2220kJ·mol-1
其中,能表示燃烧热的热化学方程式为__________,其燃烧热为______________。
19.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则12N2(g)+32H2(g)NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g)2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)2Al2O3(s) ΔH1
4Fe(s)+3O2(g)2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
20.CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO22CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________________________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
21.试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)2HCl(g) ΔH=-185kJ·mol-1
请填空:
共价键
H-H
Cl-Cl
H-Cl
键能/(kJ·mol-1)
436
247
________
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________。
2018-2019学年重庆市南开中学
高二上学期第一次月考化学试题
化学 答 案
参考答案
1.D
【解析】
【分析】
A.煤、石油、天然气都属于化石燃料;B.化石燃料的使用是二氧化碳的最大来源,少使用就可以减少二氧化碳的排放;C.硅属于半导体材料,它能把太阳能直接转化为电能;D.菠菜中的蛋白质是间接利用太阳能合成的,研究菠菜蛋白质“发电”属于太阳能文明。
【详解】
煤、石油和天然气都属于化石燃料,含有碳元素,因此也可称为碳素燃料,A正确;发展太阳能经济,就可以减少在发展经济过程中因大量使用化石燃料产生二氧化碳等温室效应气体的排放,因此有助于减缓温室效应,B正确;太阳能电池通过特殊的材料可将太阳能直接转化为电能,C正确;菠菜中的蛋白质是绿色植物菠菜通过光合作用产生的,因此目前研究菠菜蛋白质“发电”也属于“太阳能文明”,D错误。
故选D。
【点睛】
本题主要考查了与节能减排相关的知识,依据已有的知识进行解答是关键。
2.D
【解析】A. 吸热反应是指化学反应,干冰气化是物理变化,故A错误; B. 反应物的总能量低于生成物的总能量时,是吸热反应,故B错误; C. 化学反应中的能量变化除了热量变化之外还有电能、光能等,故C错误;D. 根据△H=生成物的焓−反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错误。
故选:D。
点睛:焓变只与反应物和生成物的状态有关,与反应途径及条件没有关系。
3.C
【解析】A. Ba(0H)2•8H20与NH4Cl反应属于吸热反应,但不是氧化还原反应,A错误;B. 工业合成氨是放热的氧化还原反应,B错误;C. 灼热的炭与CO2反应既属于氧化还原反应又属于吸热反应,C正确;D. 葡萄糖在人体内生理氧化是放热的氧化还原反应,D错误,答案选C。
点睛:掌握氧化还原反应的特征、判断依据以及常见的放热反应或吸热反应是解答的关键,一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,需要熟练记住。
4.A
【解析】KClO3加热制O2反应是吸热反应,故A正确;催化剂不能改变化学反应的焓变,故B错误;催化剂能同等程度的改变正、逆反应的活化能,故C错误;生成物的能量大于反应物的能量,该反应为吸热反应,故D错误。
点睛:催化剂能同等程度的改变正逆反应的活化能,所以能同等程度改变正逆反应反应速率,加入催化剂平衡不移动。
5.C
【解析】
A、由图可知:1mol C(s) 与1mol O2(g)的能量之和大于393.5 kJ,而1mol C(g) 与1mol O2(g)的能量之和远大于393.5 kJ,故A错误;B、由图可知:1molCO( g)和0.5mol的O2(g)生成1molCO2( g) 放出282.9kJ的热量,所以反应2CO( g)+O2(g)═2CO2( g) 中,反应物的总能量大于生成物的总能量,故B错误;C、由图可知:1molC(s)和0.5molO2(g)转化为1mol的CO( g),放出热量为:393.5-282.9=110.6kJ,所以2C(s)+O2(g)═2CO( g)△H=-221.2kJ/mol,故C正确;D、热值指在一定条件下单位质量的物质完全燃烧所放出的热量,燃烧产物在该条件下是一种较为稳定的状态,则CO的热值为282.928kJ/g=10.1kJ/g,单位不正确,故D错误;故选C。
点睛:本题主要考查了热化学方程式的书写以及反应热的计算,要能根据热值来计算一定量的物质燃烧时放出的热量。本题的易错点为D,要注意热值的单位。
6.A
【解析】
分析:A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,结合能量的高低解答该题。
详解:A.物质的总能量越低,越稳定,所以三种化合物的稳定性顺序:B<A<C,故A正确;B.A→B的反应为吸热反应,B→C的反应为放热反应,故B错误;C.加入催化剂,只改变反应的活化能,不改变反应热,只提高反应速率,不改变平衡移动,因此产率不变,故C错误;D.整个反应中△H=(E1-E2)+(E2-E3)-E4=E1-E3-E4,故D错误;故选A。
7.D
【解析】A. C原子半径小于Si原子半径,C-C键的键长比Si-Si键的短,键长越短化学键越稳定,键能越大,所以C-C的键能大于Si-Si,故A正确;B. H-I键的键长比H-Cl长,键长越短键能越大,化学键越稳定,氢化物越稳定,所以HCl的稳定性比HI稳定性高,故B正确;C. SiCl4是分子晶体,SiC是原子晶体,熔点:原子晶体>分子晶体,所以SiCl4的熔点比SiC熔点低,故C正确;D. 1 mol四氯化硅中含有4molSi-Cl键,拆开1 mol四氯化硅中的化学键所吸收的能量为360kJ/mol×4mol=1440kJ,故D错误;答案选D。
8.B
【解析】混合气体物质的量==5mol,设氢气、甲烷的物质的量分别是xmol、ymol,根据方程式知,氢气、甲烷完全燃烧放出的热量分别是285.8xkJ、890ykJ,列方程式组为x+y=5,285.8x+890y=3695,解得x=1.25,y=3.75,原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选B。
9.B
【解析】
【详解】
A、燃烧反应都是放热反应,故ΔH3<0,选项A错误;B、将上述反应分别编号为①②③④⑤,反应⑤是铝热反应,显然是放热反应,ΔH5<0,将反应④-反应③可得反应⑤,即ΔH5=ΔH4-ΔH3<0,选项B正确、选项D错误;将反应②+反应③可得反应3H2(g)+32O2(g)===3H2O(g),故ΔH1=23(ΔH2+ΔH3),选项C错误。答案选B。
10.B
【解析】
【详解】
A.依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-115.6 kJ/mol,故A错误;B.E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ,故B正确;C.E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,H2O中H-O键比HCl中H-Cl键强,故C错误;D.根据C的分析可知,H2O中H-O键比HCl中H-Cl键强,说明H-O键比H-Cl键稳定,即非金属性O>Cl,故D错误;故选B。
11.D
【解析】①4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) △H1=a kJ·mol-1,②4NH3(g)+2NO2(g)+O2(g)3N2(g)+6H2O(g) △H2=b kJ·mol-1,③4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H4=d kJ·mol-1,根据盖斯定律可知:将①×-②+③×即得反应:2NO(g)+O2(g)=2NO2(g)△H=a×-b+d×=kJ/mol,故选D。
12.A
【解析】
【分析】
在一定条件下,64gSO2气体物质的量为1mol,1mol二氧化硫被氧化为1mol三氧化硫共放出热量98.3kJ,则1mol二氧化硫完全反应放出热量98.3kJ,反应的热化学方程式为:SO2(g)+1/2O2(g)SO3(g);△H=-98.3kJ •mol-1。
【详解】
由物质聚集状态和对应反应的焓变可知,热化学方程式为SO2(g)+1/2O2(g)SO3(g) △H=-98.3 kJ J•mol-1,A正确;由物质聚集状态和对应反应的焓变可知,热化学方程式为2SO2(g)+O2(g)2SO3(g) △H=-196.6 kJ •mol-1,选项中三氧化硫为液态,B错误;由物质聚集状态和对应反应的焓变可知,热化学方程式为SO2(g)+1/2O2(g)SO3(g) △H=-98.3 kJ •mol-1,C错误;反应是放热反应焓变为负值,故D错误。
故选A。
【点睛】
本题考查了热化学方程式书写方法,注意反应焓变的意义是全部转化放出的热量。
13.C
【解析】
CH3COOH是弱酸,电离会吸热,浓硫酸溶解会放出大量热,这些不属于中和热,所以稀醋酸、浓硫酸、稀硝酸分别与1.0 L 0.1 mol·L−1的NaOH溶液恰好完全反应,实际放出的热量的大小顺序为浓硫酸(A)>稀硝酸(B)>稀醋酸(C),b点表示生成0.1 mol H2O(l),所以b=5.73。
14.D
【解析】
100mL 0.4mol/L Ba(OH)2溶液,放出的热量使5.12KJ ,换算成1mol Ba(OH)2完全中和的热化学方程式为:
①Ba2+(aq)+SO42—(aq)+2OH—(aq)+2H+(aq)==BaSO4(s)+2H2O(l)+;ΔH=-128 kJ·mol-1
同样:②OH—(aq)+H+(aq)== H2O(l);ΔH=-55 kJ·mol-1 ,则由①-②×2即:Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1。D正确。
15.A
【解析】
【分析】
A、正反应为放热反应,逆反应一定为吸热反应;B、H2SO4和Ca(OH)2反应生成微溶的CaSO4反应还会发出热量,则反应热ΔH小于2×(-57.3)kJ·mol-1;C、燃烧热恒为正值,但燃烧热ΔH是负值;D、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物。
【详解】
CO(g)的燃烧热可用热化学方程式表示为:CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0
kJ/mol,则逆反应的热化学方程式表示为: 2CO2(g)=2CO(g)+O2(g)ΔH=+2×283.0
kJ·mol-1,A正确;2SO4和Ca(OH)2反应生成微溶的CaSO4反应还会发出热量,则反应热ΔH小于2×(-57.3)kJ·mol-1,B错误;燃烧热是指物质与氧气进行完全燃烧反应时放出的热量,由定义知燃烧热恒为正值,但燃烧热ΔH是负值,C错误;燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,生成气态水不是稳定氧化物,甲烷的燃烧热应生成稳定的液态水和气态二氧化碳,D错误。
【点睛】
本题考查了燃烧热和中和热的概念,注意定义要点是解答的关键。
16.D
【解析】
根据氯元素的化合价,a、b、c、d、e依次代表Cl-、ClO-、ClO2-、ClO3-、ClO4-。A项,物质能量越低越稳定,由图可得a、b、c、d、e中,a最稳定,c最不稳定,故A错误;B项,反应物能量-生成物能量=-ΔH,依据图中数据无法判断b→a+c反应的活化能,故B错误;C项,a为Cl-、b为ClO-、d为ClO3-,B→A+D的化学方程式为3ClO-=ClO3-+2Cl-,结合曲线提供的数据,反应热为:ΔH=64kJ•mol-1+2×0kJ•mol-1-3×60kJ•mol-1=-116kJ•mol-1,故C错误;D项,氧化还原反应遵循电子守恒,Cl2与NaOH溶液反应生成的产物有a(Cl-)、b(ClO-)、d(ClO3-),氯元素化合价由0价将为-1价、升为+1价和+5价,由电子守恒得:n(Cl-)=n(ClO-)+5n(ClO3-),当溶液中a、b、d的浓度之比为11:1:2时上述电子守恒式成立,故D正确。
点睛:本题以卤族元素为载体考查了化学反应与能量变化、热化学反应方程式的书写、氧化还原反应等知识,关键是弄清a、b、c、d、e所代表的离子并正确书写反应的离子方程式,并结合ΔH=生成物的总能量-反应物的总能量进行计算,D项注意氧化还原反应中得失电子守恒(化合价升降总数相等)的应用。
17. EF A E CD -882 环形玻璃搅拌棒 保温隔热,防止热量散失 偏小
【解析】一般来说,活泼金属元素与非金属元素形成离子键,非金属元素之间形成共价键,(1)分子晶体熔化不破坏化学键,即EF中熔化不破坏化学键,原子晶体熔化破坏共价键,则A熔化破坏共价键,一般来说,原子晶体熔点最高,分子晶体熔点较低,E的相对分子质量小于F,则E的熔点最低;离子晶体中一定存在离子键,C、D中非金属元素之间形成共价键;(2)由题意知,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,则1 mol N4生成N2的反应为: N4(g)=2N2(g),反应热等于反应物的总键能减去生成物的总键能,故反应热△H=6×167kJ/mo l -2×942kJ/mol =-882kJ/mol;(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;烧杯间填满碎泡沫塑料的作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小。
点睛:本题考查化学键、晶体熔点比较、键的极性与分子的极性、热化学方程式以及反应热的计算,注意理解中和热的概念以及测定反应热的误差等问题。易错点为(2)由N4分子结构可知,1molN4分子中含有6molN-N键,反应热等于反应物的总键能减去生成物的总键能,据此计算解答。
18.ACDC2H5OH(l)+3O2(g)2CO2(g)+3H2O(l) ΔH=-1366.89kJ·mol-1小于吸收ACB2220kJ·mol-1
【解析】
【分析】
(1)煤可燃烧,燃烧时产生大量二氧化硫和烟尘,且燃烧效率较低,可通过洁净煤技术,如煤的气化和液化以及烟气脱硫,提高煤燃烧的热利用率;(2)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,乙醇完全燃烧生成二氧化碳和液态水,依据2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,计算1mol乙醇燃烧完全燃烧生成液态水放出的热量,据此书写乙醇燃烧热的热化学方程式;(1)依据热化学方程式分析C3H8(g)=C3H6(g)+H2(g)△H=+bkJ•mol-1,该反应属于吸热反应,反应物具有的总能量小于生成物的总能量,化学反应时需要吸收能量;(4)氧气是助燃的,水分解是吸热反应;(5)燃烧热是指1mol可燃物完全燃烧生成稳定化合物所放出的热量。
【详解】
(1)煤可燃烧,燃烧时产生大量二氧化硫和烟尘,且燃烧效率较低,可通过洁净煤技术,如煤的气化和液化以及烟气脱硫,提高煤燃烧的热利用率,如用煤直接做燃料,可导致环境污染,造成较大浪费,ACD正确。(2)乙醇完全燃烧生成二氧化碳和液态水,依据2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则1mol乙醇完全燃烧生成液态水放出的热量为:1366.89KJ,所以燃烧热
的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.89kJ•mol-1。(3)由于C3H8(g)═C3H6(g)+H2(g)的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,在化学反应时,反应物就需要需要吸收能量。(4)氧气是助燃的,且水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气,A不正确,水分解是吸热反应,C不正确,所以答案选AC。(5)燃烧热是指1mol可燃物完全燃烧生成稳定化合物所放出的热量,据题给的热化学方程式可知,B能表示C3H8燃烧热的热化学方程式,C3H8的燃烧热为2220 kJ·mol-1。
【点睛】
本题考查资源综合利用和新能源开发,涉及环境污染问题、热化学方程式的书写以及反应吸放热与反应物、生成物能量之间的关系,根据所学知识进行回答是关键。
19.CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1226.7kJ·mol-1 B
【解析】
【分析】
(1)依据图象分析反应物能量高于生成物能量,反应是放热反应,书写热化学方程式时,注意标注物质聚集状态和对应焓变的大小;(2)△H=反应物的键能-生成物的键能;(3)将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×12-③×12;(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s) △H=△H1-△H2。
【详解】
(1)由图象可知,反应物能量高于生成物能量,该反应是放热反应,1molCO完全反应放出的热量41kJ,热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol。(2)据题意,N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,由△H=反应物的键能-生成物的键能可知,0.5mol氮气和1.5mol氢气反应生成1mol氨气时△H=(3×391.55kJ·mol-1)—(0.5×948.9kJ·mol-1+1.5×436.0kJ·mol-1)=46.2 kJ·mol-1。(3)目标反应为2C(s,石墨)+H2(g)= C2H2(g),将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×12-③×12,所以反应焓变△H=2×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)×12-(-2599 kJ·mol-1)×12=+226.7 kJ·mol-1。(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2,故选B。
【点睛】
本题考查热化学方程式的书写和盖斯定律应用,依据图象分析和依据盖斯定律计算是解答的关键。
20.=D63% -74.8kJ·mol-1C
【解析】
【分析】
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890,.3kJ•mol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量;(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量,反应为放热反应,据此分析图象判断;②依据①计算得到的反应的焓变,图中中是反应达到平衡状态时放热155.8KJ,计算反应的甲烷得到转化率;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol;②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+③-①得到,由此分析解答;(4)CO2与H2O反应生成CH4与O2的反应吸热,故A项不正确;使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生,故B项不正确;利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)是合理的,C项正确;将固态碳合成为C60,以C60作为燃料,极不经济合算,故D项不正确。
【详解】
(1)给定反应的反应热只取决于反应物和生成物的多少和状态,与中间过程无关,故甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量仍等于890.3 kJ。(2)①1 g CH4完全反应释放15.46 kJ的热量,则1 mol CH4完全反应放出热量为247.36 kJ,故D图符合题意;②CH4的转化率=155.8/247.36 ×100%≈63%。(3)②+③-①即得C(s)+2H2(g)=CH4(g) ΔH=-74.8 kJ·mol-1。(4)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则CO2与H2O反应生成CH4与O2的反应吸热,故A项不正确;使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生,故B项不正确;利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)是合理的,C项正确;将固态碳合成为C60,以C60作为燃料,极不经济合算,故D项不正确,故选C。
【点睛】
本题考查了热化学方程式书写、盖斯定律计算、反应热与能源,侧重分析与应用能力的考查,把握物质的性质、反应中的能量变化、化学研究等为解答的关键。
21.NO2(g)+CO(g)NO(g)+CO2(g) ΔH=-234kJ·mol-1 434H2Se(g)Se(s)+H2(g) ΔH=-81kJ·mol-1
【解析】
【分析】
(1)由图可知反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2,依据热化学方程式书写方法写出NO2和CO反应的热化学方程式;(2)①根据△H=反应物总键能-生成物总键能计算;②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式。
【详解】
(1)结构NO2和CO反应生成CO2和NO过程中能量变化示意图可知,反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,标注物质聚集状态和对应焓变,写出NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol。(2)①△H=反应物总键能-生成物总键能=(436kJ/mol+247kJ/mol)-2E(H-Cl)=-185kJ/mol,解得:E(H-Cl)=434kJ/mol;②非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O;b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol。
【点睛】
本题考查了盖斯定律在热化学方程式中的应用,明确盖斯定律的概念及含义、注意掌握热化学方程式的书写原则为解答关键。