- 313.00 KB
- 2024-02-26 发布
2017-2018学年河北省邢台市高二上学期期末考试化学试题
可能用到的相对原于质量:H-1 C-12 N-14
(选择题 第I卷 共50分)
一、 选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1、生活中的某些问题常常涉及化学知识,下列叙述错误的是
A.明矾可用于自来水的杀菌消毒
B.纯碱可用于除去物品表面的油污
C. 轮船镶上锌块能减轻海水对船身的腐蚀
D.“煤改气”、“煤改电”等燃料改造工程有利于减少环境污染
2、 下列装置工作时,能最由光能转化为电魄的是
3、下列属于水解反应的是
A.2H2OH2O+ +OH- B.HCO3-+OH-H2O+CO32-
C.CO2+ H2OH2CO3 D.CO32-+H2OHCO3-+OH-
4、“长征八号“火箭将于2018年首飞,其燃料为偏二甲基肼(C2H8N2)。已知偏二甲基肼的燃烧热ΔH=-2000kJ/mol,则1.5g偏二甲基肼完全燃烧放出的热量为
A.25kJ B.50kJ C.75kJ D. 100 kJ
5、研究发现,腐蚀严重的青铜器表面大都存在CuCl。下列有关CuC1在青铜器腐蚀过程中起催化作用的叙述正确的是
A.增大了反应的速率 B.增大了反应的活化能
C.降低了反应的焓变 D.减小了反应的平衡常数
6、室温下,在由水电离产生的c(H+)=10-12mol/L的溶液中,能大量共存的离子组是
A.Cl-、SO42-、Na+、K+ B.HCO3-、Ba2+、Cl-、NO3-
C.I-、NO3- 、Fe2+、Ca2+ D.Na+、K+、ClO-、Al3+
7、一定温度下,在密闭容器中进行反应:N2(g)+O2(g)2NO(g),下列措施不会改变化学反应速率的是
A.缩小容器体积,增大压强 B.保持容器体积不变,充入N2
C.保持容器体积不变,充入He D.保持容器压强不变,充入He
8、下列关于酸碱中和滴定的说法中正确的是
A.一般用石蕊试液作中和滴定的指示剂
B.滴定时应控制滴加速率;先快后慢
C.标准液浓度越大,滴定误差越小
D.消定时,眼睛注视滴定管内液面的变化
9、下列事实不能证明H2C2O4(乙二酸)是弱电解质的是
A.草酸能使酸性KMnO4溶液褪色
B.常温下,0.1mol/L的H2C2O4溶液的PH=2
C.浓度均为1mol/L=l的H2C2O4溶液的导电能力比硫酸的导电能力弱
D.常温下,pH=4的H2C2O4溶液稀释100倍,pH约为5
10、某温度下的两种气体X2 和Y2 在密闭容器中发生反应生成气体Z,各物质浓度变化如下表所示,则该反
应的化学方程式可表示为气体
X2
Y2
Z
起始浓度/mol/L
1.0
1.0
0
平衡浓度/mol/L
0.4
0.6
0.4
A .2X2+3Y2 2Z B.3X2+2Y2 2Z
D.2X2+Y2 2Z C.X2+2Y2 2Z
11、0.1mol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1mol/L,要使c(CO32-)更接近于0.1mol/L,可采取的措施是
A.加入少量盐酸 B.加入适量水 C.加入适量KOH 固体 D.加热
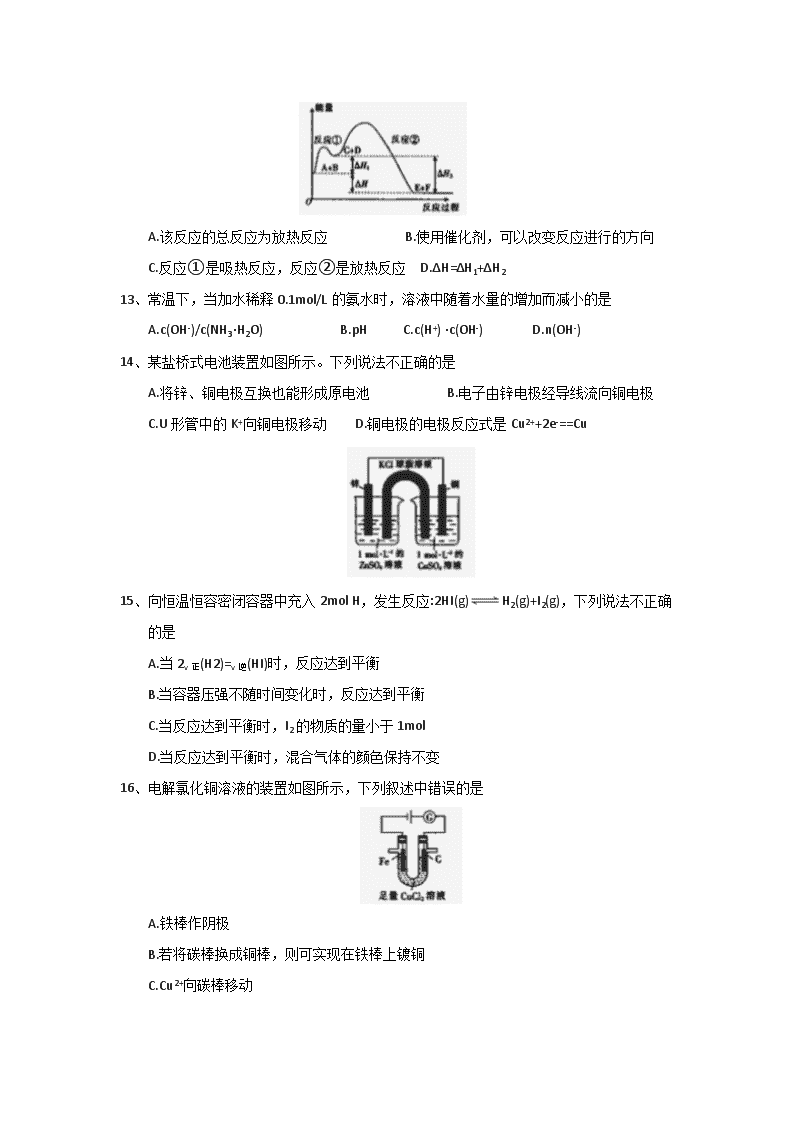
12、 某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是
A.该反应的总反应为放热反应 B.使用催化剂,可以改变反应进行的方向
C.反应①是吸热反应,反应②是放热反应 D.ΔH=ΔH1+ΔH2
12、 常温下,当加水稀释0.1mol/L的氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O) B.pH C.c(H+) ·c(OH-) D.n(OH-)
14、某盐桥式电池装置如图所示。下列说法不正确的是
A.将锌、铜电极互换也能形成原电池 B.电子由锌电极经导线流向铜电极
C.U形管中的K+向铜电极移动 D.铜电极的电极反应式是Cu2++2e-==Cu
15、向恒温恒容密闭容器中充入2mol H,发生反应:2HI(g)H2(g)+I2(g),下列说法不正确的是
A.当2v正(H2)=v逆(HI)时,反应达到平衡
B.当容器压强不随时间变化时,反应达到平衡
C.当反应达到平衡时,I2的物质的量小于1mol
D.当反应达到平衡时,混合气体的颜色保持不变
16、电解氯化铜溶液的装置如图所示,下列叙述中错误的是
A.铁棒作阴极
B.若将碳棒换成铜棒,则可实现在铁棒上镀铜
C.Cu2+
向碳棒移动
D.电解池发生总反应:CuCl2Cl2 ↑+Cu
17、25℃时,在AgCl的饱和溶液中存在平衡:AgCl(s)Ag+(aq)+Cl-(aq),加入少量NaCl固体,下列说法正确的是
A.溶液中Ag+和Cl-的浓度都增大 B.溶度积常数Ksp增大
C.沉淀溶解平衡向右移动 D.溶液中Ag+的浓度减小
18、 某实验小组研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
A.若电极d为石墨,则铁片腐蚀加快
B.若电极d为石墨,则石墨的电极反应式为O2+2H2O+4e-==4OH-
C.若电极d为锌块,则铁片不易被腐蚀
D.若电极d为锌块,则铁片的电极反应式为2H++2e-==H2↑
19、 下列图中的实验装置,能达到实验目的的是
A.装置甲:用氯化铁溶液直接蒸发结晶获得无水氯化铁
B.装置乙:验证CuCl2对H2O2分解有催化作用
C.装置丙:验证2NO2(g)N2O4(g) ΔH<0
D.装置丁:测定未知盐酸的浓度
20、 下列电极反应式与相应的环境相匹配的是
选项
电极反应式
相应的环境
A
O2+2H2O+4e-=4OH-
碱性环境下氢氧燃料电池的负极反应
B
4OH-+4e-==O2↑+2H2O
弱酸性环境下钢铁的吸氧腐蚀
C
Cu-2e-==Cu2+
用钢作电极电解NaCl溶液的阳板反应
D
H2-2e-==2H+
用情性电餐电解H2SO4溶液的阳极反应
21、已知镉镍可充电电池的反应原理为Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2,由此可知,下列判断错误的是
A.放电时,Cd 作负极
B.充电时,Ni(OH)2 在阴极被还原
C.电解质溶液为碱性溶液
D.放电时,负极上发生的电极反应为Cd+2OH--2e-==Cd(OH)2
22、对于可逆反应:PCl3(g)PCl3(g)+Cl2(g) ΔH>0,下列图像中正确的是
23、科学家设想以N2 和H2 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型电池,其装置如图所示,下列说法不正确的是
A.b电极为负极
B. A为NH4Cl
C.该电池外电路中的电流从a电极流向b电极
D.电路中转移3mol电子时,有11.2LN2参加反应
24、下列实验操作能达到相应实验目的的是
选项
实验操作
实验目的
A
室温下,用pH试纸分别测定浓度均为0.1mol/LHClO
溶液和CH3COOH溶液的pH
比较HClO和CH3OOOH
的酸性强弱
B
向 10 mL浓度均为 0.1 mol/ L 的 BaCl2 和 CaCl2混合
溶液中加入10mL0.1mol/LNa2SO4溶液,出现白色沉淀
证明Ksp(BaSO4)< Ksp(CaSO4)
C
向含有酚酞试液的Na2CO3溶液中加入少量BaCl2固体,
溶液红色变浅
证明Na2CO3溶液
中存在水解平衡
D
室温下,等体积、pH=2的HA和HB两种酸分别与足
量Zn反应,HB放出的H2多
证明HB是强酸
25、电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100 mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示(忽略混合时溶液的体积变化)。下列说法不正确的是
A.曲线①代表CH3COOH溶液的滴定曲线
B. A、C两点对应溶液均呈中性
C.B点对应的溶液中:c(Na+)>c(OH-)>c(CH3COO-)
D.A点对应的溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
第II卷 (必考题40分十选考题10分,共50分)
【必考题】
一、 (本题包括3小题,共40分)
26、(13分)按要求回答下列问题:
(1)某温度下,纯水中的c(H+ )=2.0×10-7 mol/L,则此温度下的Ksp=_________;若温度不变,滴入NaOH
稀溶液,使c(OH-)=5.0×10-6 mol/L,则溶液的c(H+)=__________。
(2) 在25℃时,100mL 1.0mol/L盐酸与等体积1.2mol/L的氢氧化钠溶液混合(忽略混合前后溶液体积的变化),混合后溶液的pH=_____________________。
(3)某些弱酸的电离平衡常数(常温下)如下表所示。
弱酸
电离平衡常数
弱酸
电离平衡常数
HClO
K=3.0×10-8
HCOOH
K=1.8×10-4
H3PO4
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-12
H2C2O4
K1=5.9×10-2
K2=6.4×10-5
请根据要求作答
①比较上述四种弱酸的酸性强弱(由大到小):________________________________。
②写出H3PO4溶液和HCOONa溶液反应的离子方程式:__________________________。
③25℃时,1mol /L 的NaHC2O4溶液的pH<7,写出溶液中离子浓度由大到小的顺序:________________
27、(13分)某小组为研究电化学原理,设计如图所示装置。
(1)
若a和b不相连,c是铜片,d是锌片,m是稀硫酸,则锌片上的现象是___________,此时能量转化的主要形式是化学能转化为_______能。
(2)若a和b用导线相连:
①c是石墨电极,d是铜片,m是硝酸银溶液,电池总反应的离子方程式为______________。
②c、d均是Pt电极,m是稀硫酸,分别向两极通入甲烷和氧气,通入甲烷一极的电极反应式是_________。
(3)若a和b分别连接直流电源的两电极:
①利用该装置实现粗铜的精炼,粗铜应作_____________(填“ 极”或“ 阳 极 ”)。
②c、d是石墨电极,m是NaC1溶液,向溶液中滴加几滴酚酞试液。实验开始后c极周围溶液首先出现红色,则b连接直流电源的_________ (填“正极”或“ 负 极”), 通电时总反应的离子方程式是___________,检验d极气体产物的方法是________________________________。
③c、d分别是石墨电极和铜电极,m是NaOH依溶液,通过反应:2Cu+H2OCu2O+H2 ↑可制得纳米级Cu2O。阳极的电极反应式是_________________________。
28、(14分)研究NO2、NO、CO等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:
II.NO2(g)+CO(g)CO2(g)+NO(g) ΔH1 K1(该反应的平衡常数,下同)
1mol 下列物质分解为气态原子所消耗的能量如下:
NO2
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
II.N2(g)+O2(g)2NO(g) ΔH2=+179.5kJ/mol K2
III.2NO(g) + O2(g)2NO2 (g)ΔH2=-112.3kJ/mol K3
①ΔH1=________________________。
②写出NO与CO反应生成无污染气体的热化学方程式:_________________;该反应的平衡常数K=_______
(用含K1、K2、K3的代数式表示)
(2)污染性气体NO2 与CO在一定条件下发生的反应为2NO2(g)+4CO(g)4CO2(g)+N2(B),310K下,向1L的恒温恒容密闭容器中充人0.1molNO2和0.2molCO,5min后反应达到平衡,此时NO2的浓度为0.05mol/L。
①反应从开始到5min时,CO的平均反应速率v(CO)=.__________,NO2 的平 衡 转 化 率 a=___,310K时,上述反应的平衡常数K=___________________。
②在350K下,重复上述实验,平衡后NO2 的物质的量分数为30%,则该反应的ΔH______(填“>”“<“或“=”)0。
【选考题】
一、 (本题包括2小题,每小题10分,只能选择一题作答)
29、(10分)(物质结构与性质)A、B、C、D、E是原子序数依次增大的五种短周期元素,A的基态原子有3
个不同的能级,各能缓中电子数相等;C的基态原子2P能级上的未成对电子数与A原子相同;B3-与D2+具有相同的电子层结构;E元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大。
(1)E在元式周期表中的位置是______________________________。
(2)B3-的核外电子排布式为______________________________________。
(3)D元素与B元素形成的化合物的化学式为___________________________。
(4)A、B、C 三种元素的原子半径由大到小的顺序是______(用元素符号表示,下同),第一电离能由大到小的顺序是_________________,电负性由大到小的顺序是__________________。
30、 (10分)(有机化学基础)我们所学的烃和烃的衍生物具有下列转化关系,请回答有关问题。
(1)A中官能团的名称是_________,D中官能团的名称是____________,B中官能团的结构式是______
(2)反应①的反应类型是__________________________。
(3)E的核磁共振氢谱有________ 组峰,峰面积之比为______________。
(4)的名称是__________________________________。
(5)若丙醇中混有少量乙醇,可采用的提纯方法为______(填字母)。
A.重结晶 B.分液 C.蒸馏 D.萃取
1-5:ABDBA 6-10:ACBAB 11-15:CBBAB 16-20:CDDCC 21-25:BADCB
26、 (1)4.0×10-14(2分):8.0×10-9mol/L(2分)
(2)13(2 分)
(3)①H2C2O4>H3PO4>HCOOH>HClO(2 分)
②H3PO4+ HCOO-==H2PO4-+ HCOOH(2分)
③c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)(3 分)
27、(1)锌片溶解,且锌片有气泡生成(1分);热(1分)
(2)①Cu+ 2Ag+==Cu2+ +2Ag(2 分)
②CH4+ 2H2O-8e-==CO2+8H+ (2 分)
(3)①阳极(1分)
②正极(1分);2C1-+ 2H2O2OH-+ Cl2↑+ H2 ↑(2 分);用湿润的淀粉KI试纸接近d极气体产物,试纸变
蓝(1分)
③2Cu+ 2OH--2e-Cu2O+ H2O(2 分)
28、(1)①-234kJ/mol(2分)
②2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH= -759.8kJ/mol(2分); [K3·]/K2(2 分)
(2)①0.02mol/(L·min)(2分);50%(2分);10(2分) ② <(2分
29、(1)第三周期WIA族(2分)
(2)1s22s22p6(l 分)
(3)Mg3N2(1分)
(4)C>N>O(2 分):N >O>C(2 分);O>N>C(2 分)
30、(1)羟基(1分);醛基(1分); (2 分)
(2)加成反应1分
(3)3(1分);3:2:3(或2:3:3或3:3:2)(1分)
(4)2.4 二甲基-2 一己烯(2 分)
(5)C(1分)