- 894.00 KB
- 2024-01-17 发布
高考频度:★★★★☆ 难易程度:★★★☆☆
1.对于密闭容器中进行的反应:2SO2+O22SO3,如果温度保持不变,下列说法中正确的是
A.增大SO2的浓度,逆反应速率减小
B.使用合适的催化剂,平衡常数增大
C.增大SO2的浓度,平衡常数增大
D.减小O2的浓度,平衡常数不变
2.下列变化一定会引起平衡移动的是
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化
A.①②⑥⑦⑧ B.②④⑤⑥⑧
C.②④⑤⑥⑦ D.③④⑦⑧
3.下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g) SO3(g)+NO(g) ΔH<0
B.C(s)+CO2(g) 2CO(g) ΔH>0
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
D.H2S(g) H2(g)+S(s) ΔH>0
4.如图为800 ℃时A、B、C三种气体在密闭容器中反应时的浓度变化,从图上分析,下列结论错误的是
A.发生的反应可表示为2A(g)2B(g)+C(g)
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.开始时,正逆反应同时进行
D.2 min时,A、B、C的浓度之比为2∶3∶1
5.已知反应:A(g)+3B(g)2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
6.在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)2c(g) ΔH1<0
x(g)+3y(g)2z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
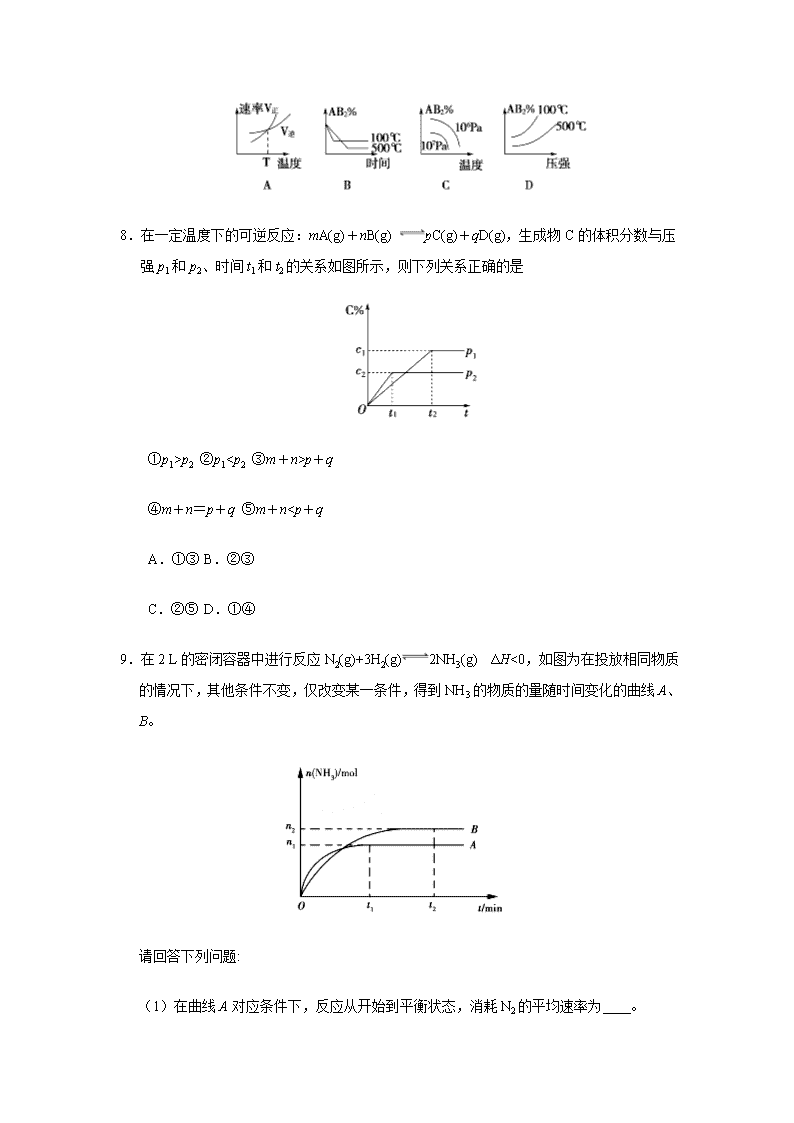
7.对于反应A2(g)+2B2 (g) 2AB2(g) ΔH<0 ,下列各图所表示的变化符合勒夏特列原理的是
8.在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是
①p1>p2 ②p1p+q
④m+n=p+q ⑤m+nTB
(3)曲线A、B对应条件下平衡常数的大小关系为KA (填“>”、“<”或“=”)KB。
(4)下列能说明该反应达到平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器内的压强为起始时的,则此温度下的平衡常数为 。
10.已知NO2和 N2O4 可以相互转化:2NO2(g)N2O4(g) ΔH<0。现将一定量NO2和 N2O4 的混合气体通入体积为1 L的恒温密闭容器中,反应体系中物质浓度随时间变化的关系如图所示。
根据题图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的是 。
(2)前10 min内用NO2表示的化学反应速率v(NO2)= mol/(L·min);反应进行至25 min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25 min 时还可以采取的措施是 (填字母) 。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
1.【答案】D
2.【答案】D
【解析】引起平衡移动的根本原因是化学反应速率的变化,但反应速率变化,平衡也可能不移动,主要看v正与v逆是否相等,如果v正≠v逆,则平衡必然要发生移动,如果v正、v逆同时改变,但始终保持相等,则平衡不移动,故①不一定引起平衡移动。对于反应前后气体分子数不变的反应,缩小容器体积(增大压强),各气体浓度均增大,但平衡不移动,故②不一定引起平衡移动。对于反应前后气体分子数不变的反应,颜色变化,平衡不一定发生移动,故⑤不一定引起平衡移动。对于反应前后气体分子数不变的气体反应,缩小容器体积(增大压强),混合气体密度增大,但平衡不移动,故⑥不一定引起平衡移动。各组分百分含量的变化、平均相对分子质量的变化、转化率的变化、温度的变化均一定会引起平衡移动,即③④⑦⑧一定会引起平衡移动,故选D。
3.【答案】B
【解析】加压化学平衡向气体体积减小的方向移动,降温化学平衡向放热反应方向移动。A、D项,加压平衡不移动;C项加压平衡逆向移动,降温正向移动。
4.【答案】C
【解析】A项,根据图象可知,A是反应物,B、C是生成物,在2 min内A、B、C的浓度变化量分别是0.2 mol·L-1、0.2 mol·L-1、0.1 mol·L-1。在相同时间内,各物质的浓度变化量之比等于反应方程式中各物质的化学计量数之比,所以反应方程式为2A(g)2B(g)+C(g);B项,在前2 min,A的分解速率v(A)=(0.4 mol·L-1-0.2 mol·L-1)÷ 2 min=0.1 mol·L-1·min-1;C项,开始时,C的浓度为0 mol·L-1,逆反应无法进行;D项,2 min时,A、B、C的浓度(mol·L-1)之比为0.2∶0.3∶0.1=2∶3∶1。
5.【答案】C
【解析】温度降低,正、逆反应速率都减小,故A、B两项错误;对于此反应,降低温度平衡向着放热反应方向移动,即向着正反应方向移动,故D项错误。
6.【答案】A
7.【答案】D
【解析】升高温度平衡应逆向移动,逆反应速率应大于正反应速率,不符合勒夏特列原理,故A错误;升高温度平衡应逆向移动,温度越高AB2的含量越小,符合勒夏特列原理但不符合先拐温度越高原则,故B错误;增大压强平衡正向移动,所以压强越大AB2的含量越大,不符合勒夏特列原理,故C错误;增大压强平衡正向移动,所以压强越大AB2的含量越大,温度越高AB2的含量越小,符合勒夏特列原理,故D正确。
8.【答案】C
【解析】由“先拐先平数值大”原则知p2>p1,压强越大C%越小,说明增大压强平衡逆向移动,即m+nTA,则升高温度,化学反应速率加快,曲线B应先达到平衡,但NH3的量反而降低,故D正确。
(3)由于曲线A对应的温度高于曲线B对应的温度,且该反应的正反应为放热反应,故KA