- 198.50 KB
- 2024-01-05 发布
全椒中学2016——2017学年度第二学期期中考试
高二年级化学试卷
命题人:刘正龙 审核人:蔡超
一、单项选择题(每小题3分,16小题,共48分)
1.以下观点正确的是( )
A. 化学反应的反应热与反应的途径有关
B. 非自发反应在任何条件下都不可能发生
C. 化学平衡常数的表达式与化学反应方程式的书写有关
D. 强电解质溶液的导电能力一定强于弱电解质溶液
2.下列有关反应热的叙述中正确的是( )
①己知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为△H=-241.8kJ/mol
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
共价键
C-C
C=C
C-H
H-H
键能(kJ/mol)
348
610
413
436
③X(g)+Y(g)Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④己知:
上表数据可以计算出的焓变
⑤ 根据盖斯定律,推知相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
A. ①②③ B. ④⑤ C. ④ D. 无
3.反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k·Cm(H2)·Cn(Cl2),式中的k为常数,m和n的值以可用下列表中数据确定之( )
H2(mol/L)
Cl2(mol/L)
V(mol/L·S)
1.0
1.0
1.0k
2.0
1.0
2.0k
2.0
4.0
4.0k
由此可以推得,m和n的值正确的是
A.m=1,n=2 B.m=1,n=1/2 C.m=1/2、n=1/2 D.m=1/2,n=1
4.下列关于化学反应速率的说法正确的是( )
①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高,化学反应速率越快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④3 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大
⑤有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子数,从而使反应速率增大
⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
A.②⑥ B.②⑤ C.①②③⑤ D.①②④⑤
5.某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是( )
A.H2O2的分解反应为放热反应
B.FeCl3是H2O2分解反应的催化剂
C.将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同
D.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多
6.氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是( )
A.反应开始时速率增大可能是c(H+)所致
B.后期反应速率下降的主要原因是反应物浓度减小
C.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合
D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加
7.在以下说法中正确的是( )
A.已知A(s)B(g) + C(g) ,当物质C的体积分数保持不变可以说明反应达到平衡状态
B.绝热恒容体系中发生N2O4的分解反应,当体系温度不变时反应达到平衡
C.已知C(s)+H2O(g)CO(g)+H2(g),某温度下K=1,当各气体浓度相等时体系一定平衡
D.已知C(s)+H2O(g)CO(g)+ H2(g),气体平均相对分子质量不变时说明体系一定平衡
8将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)3Z(g);ΔH>0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
选择
改变的条件
正、逆反应速率变化
新平衡和原平衡比较
A
升高温度
逆反应速率增大量大于正反应速率增大量
X的体积分数变大
B
增大压强
正反应速率增大,逆反应速率减小
Z的浓度不变
C
减小压强
正、逆反应速率都减小
Y的体积分数变大
D
充入一定量Z
逆反应速率增大
Z的体积分数变大
9.己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+Cr2O72-(橙红色)+H2O。下列说法正确的是( )
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 增大CrO42-浓度,平衡向右移动,平衡常数增大
D. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
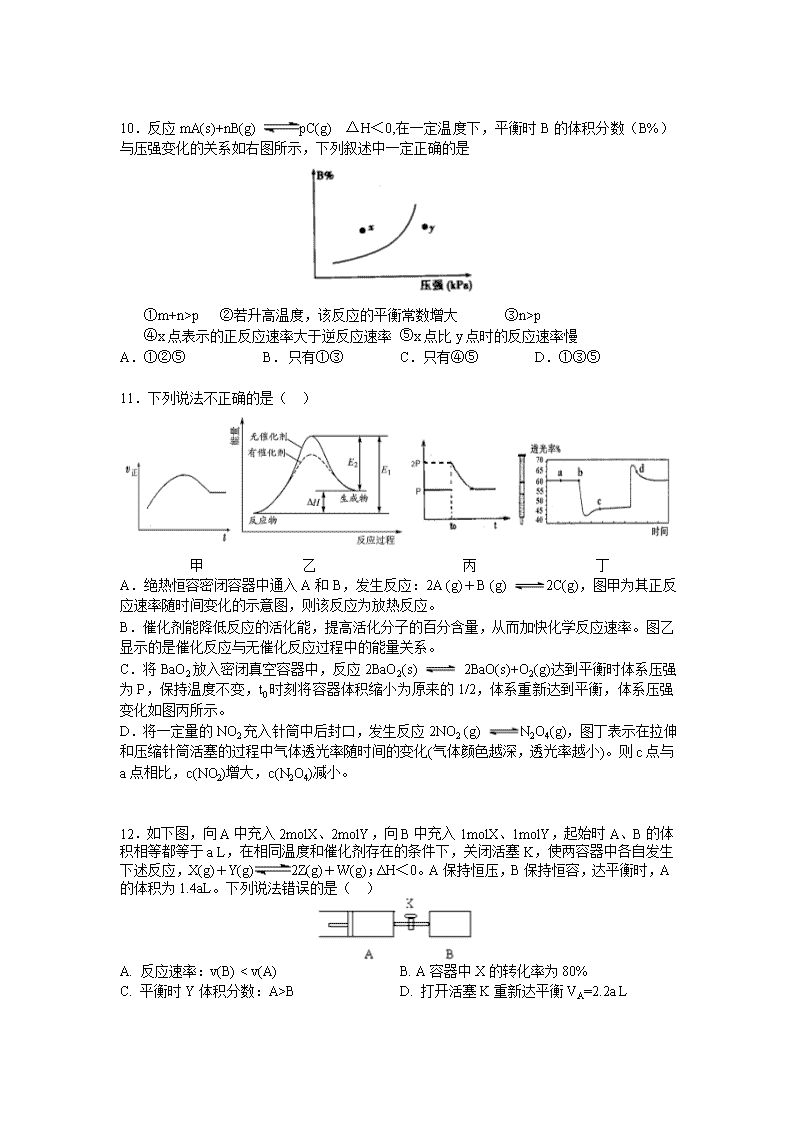
10.反应mA(s)+nB(g) pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是
①m+n>p ②若升高温度,该反应的平衡常数增大 ③n>p
④x点表示的正反应速率大于逆反应速率 ⑤x点比y点时的反应速率慢
A.①②⑤ B. 只有①③ C.只有④⑤ D.①③⑤
11.下列说法不正确的是( )
甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g) 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。
B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。
C.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。
12.如下图,向A中充入2molX、2molY,向B中充入1molX、1molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是( )
A. 反应速率:v(B) < v(A) B. A容器中X的转化率为80%
C. 平衡时Y体积分数:A>B D. 打开活塞K重新达平衡VA=2.2a L
13.常温下,有下列四种溶液:①0.1 mol/L NaOH溶液 ②pH = 11 NaOH溶液 ③0.1 mol/L CH3COOH溶液 ④pH = 3 CH3COOH溶液 ⑤pH = 3 HCl溶液,下列说法正确的是( )
A.由水电离出H+的浓度c(H+):①>③
B.将等体积的④、⑤分别加蒸馏水稀释至pH = 6,加入水的体积:④>⑤
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,得到的溶液pH>7
14.下列实验误差分析正确的是( )
A. 用润湿的pH试纸测稀酸溶液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取滴定溶液体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差偏小
15.利用电导率传感器可绘制电导率曲线图,下图为用0.1 mol·L-1NaOH溶液滴定10 mL,0.1 mol·L-1盐酸过程中的电导率曲线。下列说法错误的是( )
A. 电导率传感器能用于判断酸碱中和滴定的终点
B. 该过程中,a点所示溶液的导电性最强
C. c点电导率最小是因为此时溶液中导电微粒的数目最少
D. d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+)
16.浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.当 =2时,两溶液同时升高温度,则 增大
D.若两溶液无限稀释,则它们的c(OH-)相等
二、非选择题(5小题,共52分)
17.(1)在一定条件下,CH4可与NOx反应除去NOx,已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
②N2(g)+2O2(g)2NO2(g) △H=+67.0kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0kJ·mol-1
则CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
(2)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如右图。
从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。
(3)硫代硫酸钠溶液与稀硫酸反应可出现浑浊,下表是某同学用该反应探究化学反应速率的实验记录。请回答以下问题:
实验序号
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
5
0.1
10
B
25
5
0.1
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
V1
①该反应的化学方程式:
②V1=_________mL;
③出现浑浊由快到慢的顺序是(填实验序号)__________________。
18.科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 ȹ(CH3OH)与反应温度T的关系如右图,则上述CO2转化为甲醇的反应的△H_____0(填“>”、“<”、“=”)
(3)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______。
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3
D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_________(保留一位小数)。
19.已知:
酸
H2C2O4
HF
H2CO3
H3BO3
电离平衡常数Ka
Ka1=5.9×10-2
Ka2=6.4×10-5
未知
Ka1=4.2×10-7
Ka2=5.6×10-11
5.8×10-10
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
①甲同学取一定体积的HF溶液,滴入2滴紫色石蕊试液,显红色,再加入NaF固体观察到的现象是_______________,则证明HF为弱酸。
②乙同学取10ml未知浓度的HF溶液,测其pH为a,然后用蒸馏水稀释至1000ml。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<_________(用含a的代数式表示)。
③丙同学用pH是指测得室温下0.10mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为__________________。
(2)①已知H3BO3与NaOH溶液反应的离子方程为H3BO3+OH-=B(OH)4-,请写出硼酸的电离方程式_____ ____。
②NaHC2O4溶液中加入少量的Na2CO3溶液,反应的离子方程式__________________________。
20.(1)某学生用0.10mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂。
在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.配制NaOH标准液的试剂中含Na2CO3
B.锥形瓶水洗后未用待测盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数 ,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若恰好中和后NaOH溶液多加一滴(体积为0.04mL),此时溶液总体积为40.00mL,则所得溶液的pH为 。
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图像,当滴加NaOH溶液为10mL时,该混合液的pH= ,(含lg表达式)
(4)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数
待测液体积(mL)
标准KMnO4溶液体积(mL)
滴定前读数
滴定后读数
第一次
25.00
0.50
23.40
第二次
25.00
4.00
23.90
第三次
25.00
5.00
25.10
①滴定时,滴定终点时滴定现象是____________________________。
②该草酸溶液的物质的量浓度为_____________。
21.在2.0L密闭容器中放入0.20mol A(g),在一定温度进行如下反应:
A(g)B(g)+C(g) △H=+85.1 kJ∙mol—1
反应时间(t)与容器内气体总压(p)的数据见下表:
时间t/h
0
1
2
4
8
16
20
25
30
总压p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
由总压强p和起始压强p0,通过列式运算回答下列问题
(1)反应物A的转化率a (A)的表达式(用p和p0表示),以及平衡时A的转化率
(2)计算反应的平衡常数K的值
全椒中学2016——2017学年度第二学期期中考试
高二化学答案
一、选择题
题号
1
2
3
4
5
6
7
8
C
D
B
B
D
C
B
D
题号
9
10
11
12
13
14
15
16
D
C
D
D
B
D
C
C
二、非选择题
17题
(1)-875.3
(2)①C ②氨气浓度上升,催化剂表面吸附的氨气增多
氨气浓度过高阻碍产物从催化剂表面脱离
(3) ①Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
②10
③D C B A
18题
(1)BC
(2)<
(3)①CD ② 22.7g/mol
19题
(1)①红色变浅;②a+2 ③1.0x10-3
(2)①H2BO3+H2OB(OH)4-+H+;②2HC2O4-+CO32-=2C2O42-+H2O+CO2↑
20题
(1)ADF
(2)10
(3)1+lg3
(4)①锥形瓶中溶液由无色变为紫红色,且半分钟不褪色
②0.2mol/L
21题
(1)α(A)=(-1)×100%;94.1%;
(2)K==0.75