- 548.50 KB
- 2023-12-04 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
广东省清远市方圆培训学校2020届
化学模拟试题精练(十六)
(考试用时:50分钟 试卷满分:100分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
7.化学在生产、生活中有广泛的应用。下列做法正确的是( )
A.用硫黄熏蒸馒头,使馒头变得更白
B.将海产品用甲醛溶液浸泡以延长保鲜时间
C.用K2FeO4代替氯气给自来水消毒,提高效率并减少二次污染
D.在熟食中添加过量的亚硝酸钠,防腐并改善肉食的色泽与口感
解析:选C 二氧化硫是有毒气体,该做法会危害人体健康,故A错误;甲醛有毒,所以不用甲醛溶液浸泡海产品以保鲜,故B错误;氯气给自来水消毒会产生有机氯化物,影响人体健康,用K2FeO4代替氯气给自来水消毒,可以提高效率并减少二次污染,故C正确;亚硝酸钠是常见的致癌物质,在熟食中添加过量的亚硝酸钠,会危害人体健康,故D错误。
8.下列关于有机化合物的说法正确的是( )
A.1 mol苹果酸(HOOCCHOHCH2COOH)可与3 mol NaHCO3发生反应
B.等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等
C.以淀粉为原料可以制取乙酸乙酯
D.丙烯和HCl反应只生成CH3CH2CH2Cl
解析:选C 羧基能与NaHCO3反应,羟基不能与NaHCO3反应,1 mol苹果酸含有2 mol羧基,故其可与2 mol NaHCO3反应,A项错误;C2H6O可改写为C2H4·H2O,可以看出等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等,B项错误;淀粉水解得到葡萄糖,葡萄糖在酒化酶的催化作用下产生乙醇,乙醇氧化得到乙酸,乙酸和乙醇发生酯化反应得到乙酸乙酯,C项正确;丙烯与氯化氢加成反应的产物有两种,分别为CH3CH2CH2Cl和CH3CHClCH3,D项错误。
9.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.标况下,11.2 L氟化氢中含有的电子数为5NA
B.6.0 g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C.100 mL 0.1 mol/L 的KAl(SO4)2溶液中含有的阳离子总数为0.02NA
D.分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
9.解析:选B。A.标况下,氟化氢为液体,不可利用气体摩尔体积计算,故A不正确;B.甲醛(HCHO)和醋酸的最简式相同,均为CH2O,所以先计算最简式的物质的量,再根据最简式物质的量计算混合物中含有的原子总数即可,原子数为=0.8NA
- 14 -
,故B正确;C.因为Al3++3H2OAl(OH)3+3H+,会让阳离子数目略有增加,所以100 mL 0.1 mol/L 的KAl(SO4)2溶液中含有的阳离子总数略大于0.02NA,故C不正确;D.2H2O22H2O+O2,双氧水中氧元素是从-1价升高到0价,所以每生成1 mol氧气转移2 mol电子;2KMnO4K2MnO4+MnO2+O2,高锰酸钾中氧元素是从-2价升高到0价,所以每生成1 mol氧气转移4 mol电子,故D不正确。
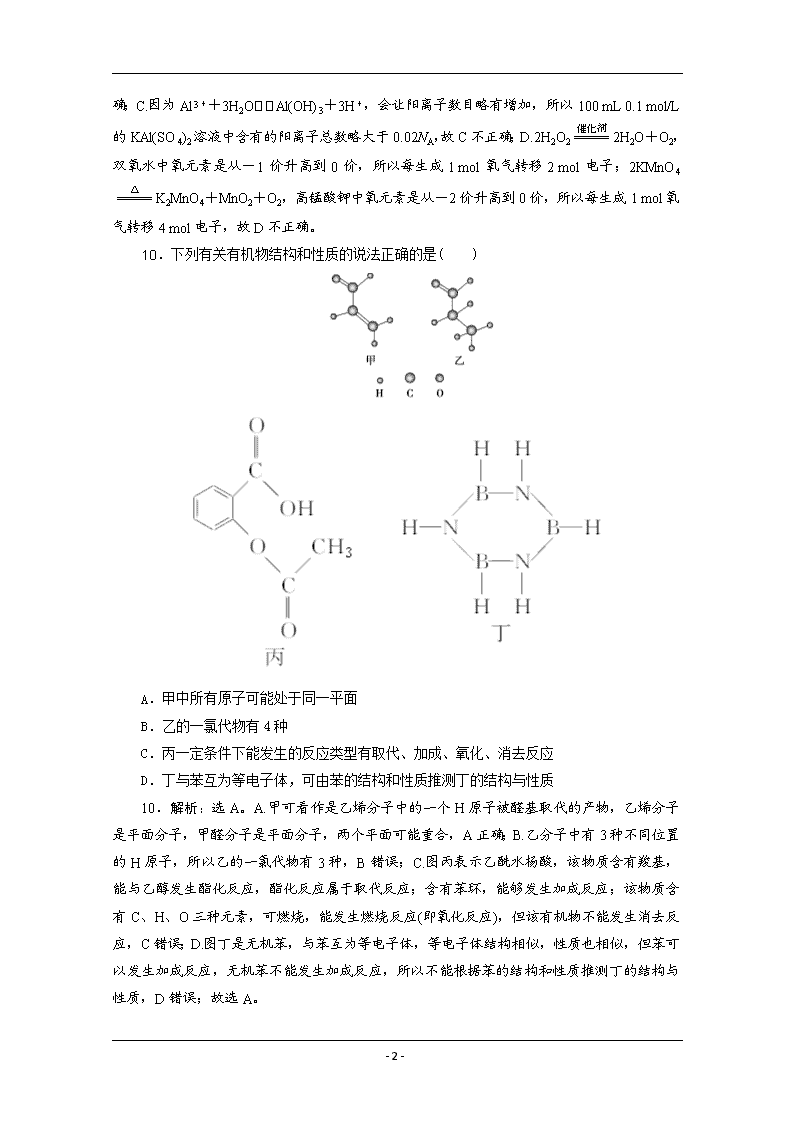
10.下列有关有机物结构和性质的说法正确的是( )
A.甲中所有原子可能处于同一平面
B.乙的一氯代物有4种
C.丙一定条件下能发生的反应类型有取代、加成、氧化、消去反应
D.丁与苯互为等电子体,可由苯的结构和性质推测丁的结构与性质
10.解析:选A。A.甲可看作是乙烯分子中的一个H原子被醛基取代的产物,乙烯分子是平面分子,甲醛分子是平面分子,两个平面可能重合,A正确;B.乙分子中有3种不同位置的H原子,所以乙的一氯代物有3种,B错误;C.图丙表示乙酰水杨酸,该物质含有羧基,能与乙醇发生酯化反应,酯化反应属于取代反应;含有苯环,能够发生加成反应;该物质含有C、H、O三种元素,可燃烧,能发生燃烧反应(即氧化反应),但该有机物不能发生消去反应,C错误;D.图丁是无机苯,与苯互为等电子体,等电子体结构相似,性质也相似,但苯可以发生加成反应,无机苯不能发生加成反应,所以不能根据苯的结构和性质推测丁的结构与性质,D错误;故选A。
- 14 -
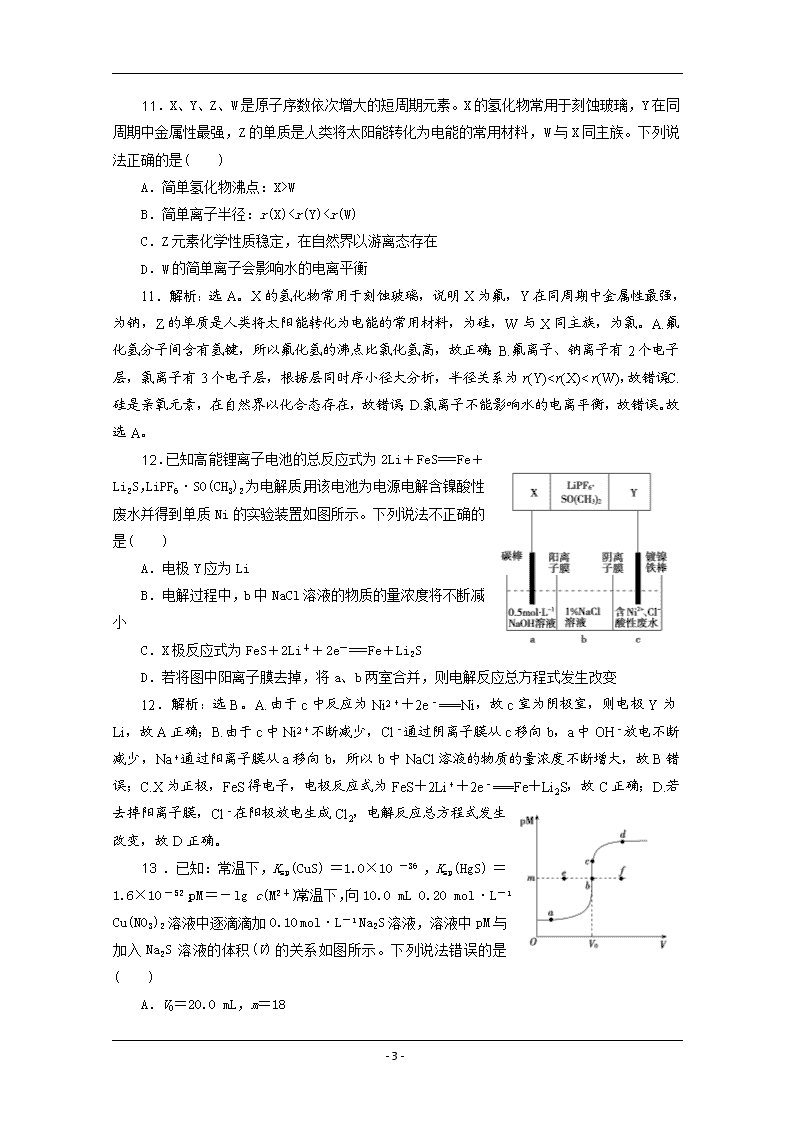
11.X、Y、Z、W是原子序数依次增大的短周期元素。X的氢化物常用于刻蚀玻璃,Y在同周期中金属性最强,Z的单质是人类将太阳能转化为电能的常用材料,W与X同主族。下列说法正确的是( )
A.简单氢化物沸点:X>W
B.简单离子半径:r(X)7 时,Fe2+部分生成 Fe( Ⅱ)氨配离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量Fe的作用是_______________________________________________。
(2)生成TiO(OH)2的化学方程式为________________________________。
(3)滤渣Ⅰ、滤渣Ⅱ均含有的物质的化学式为____________________。
(4)加入H2O2的目的是除掉Fe(Ⅱ)氨配离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫粒子主要存在形式与pH的关系如图所示。
用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解w g 二氧化钛样品,用铝粉作还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为Ti3++Fe3+===Ti4++Fe2+。
①判断滴定终点的方法:________________________。
②滴定终点时消耗c mol/L NH4Fe(SO4)2溶液V mL,则TiO2纯度为_________(写岀相关字母表示的代数式)。
26.解析:(1)根据题意分析,铁粉主要作用是将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀;(2)根据流程图,用氨水调节pH=3,TiO2+生成TiO(OH)2,所以化学方程式为TiOSO4+2NH3·H2O===TiO(OH)2↓+(NH4)2SO4;(3)滤渣Ⅰ为氢氧化亚铁和氢氧化铝,部分氢氧化亚铁氧化为氢氧化铁,滤渣Ⅱ为氢氧化铁沉淀,因此滤渣Ⅰ、滤渣Ⅱ均含有的物质为Fe(OH)3;(4)在碱性溶液中,加入H2O2的目的是氧化除掉Fe(Ⅱ)氨配离子[Fe(NH3)2]2+得到氢氧化铁沉淀,根据化合价升降守恒,配平后的离子方程式为2[Fe(NH3)2]2++4OH-+4H2O+H2O2===2Fe(OH)3↓+4NH3·H2O,氧化剂为H2O2,还原剂为[Fe(NH3)2]2+,氧化剂与还原剂的物质的量之比理论上等于1∶2;(5)根据常温下,含硫粒子主要存在形式与 pH的关系图,阳极放电的离子主要是HSO,则阳极区电解质溶液的pH范围应控制在0~2,阳极发生氧化反应,HSO放电转化为S2O,则阳极的电极反应为2HSO-2e-===S2O+2H+;(6)①铁离子过量时,反应结束,故判断滴定终点方法:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30
- 14 -
s内不恢复原色;②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=c mol· L-1×V×10-3 L×100 mL/25 mL=4cV×10-3 mol,TiO2纯度为4cV×10-3 mol×80 g·mol-1/w×100%=%。
答案:(1)将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀 (2)TiOSO4+2NH3·H2O===TiO(OH)2↓+(NH4)2SO4 (3)Fe(OH)3 (4)1∶2 (5)0~2 2HSO-2e-===S2O -+2H+ (6)①当滴入最后一滴硫酸铁铵溶液时,溶液变为血红色且30 s内不恢复原色 ②%
27.(14分)某学习小组拟设计实验探究铁盐与碳酸盐反应的产物。
序号
实验操作
主要现象
Ⅰ
10 mL 0.5 mol·L-1 FeCl3溶液和20 mL 0.5 mol·L-1 Na2CO3溶液混合
产生棕色沉淀、无气泡
Ⅱ
10 mL 0.5 mol·L-1 FeCl3溶液和20 mL 0.5 mol·L-1 NaHCO3溶液混合
产生红褐色沉淀、产生大量气泡
对实验Ⅰ、Ⅱ反应后的混合物进行过滤洗涤、低温晾干,分别得到M、N固体。回答下列问题:
(1)用pH计分别测定0.5 mol·L-1 NaHCO3溶液、0.5 mol·L-1 Na2CO3溶液,得pH依次为a、b。预测a________b(填“>”“<”或“=”)。
(2)为了定性确认M、N成分,进行实验:
实验操作
实现现象
结论
①取少量M于试管,滴加足量的稀硫酸,再滴加X溶液
沉淀溶解,产生大量气泡,溶液变红色
M一定含Fe3+、CO
②取少量N于试管,滴加足量的稀硫酸,再滴加X溶液
沉淀溶解,无气泡产生,溶液变红色
N是________(填化学式)
X的化学式为________________________。
(3)为了进一步探究M(无结晶水的纯净物)的组成进行如下实验:
①点燃酒精灯前,先通入N2,其目的是______________________。加热一段时间后,装置A中棕色粉末变红色,装置B中白色粉末变蓝色;装置C中产生白色沉淀。当装置A中M完全反应时停止加热,继续通入N2。
②停止加热之前___________先拆去B、C之间导管(填“要”或“不要”)。
- 14 -
③对装置C中混合物进行过滤、洗涤、干燥、称重,白色固体质量为19.7 g。装置A中残留红色粉末的质量为8.0 g,则M的化学式为___________。
(4)FeCl3溶液和Na2CO3溶液反应的离子方程式为__________________。
(5)铁盐与碳酸盐溶液反应产物不同可能与______________、浓度、水解产物CO2有关。
27.解析:(1)同浓度的Na2CO3水解能力大于NaHCO3,故Na2CO3溶液碱性强,得pH为a”“<”或“=”)。由实验数据得到v2正-c(O2)的关系可用图1表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
- 14 -
图1 图2
(2)通过图2所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为________________________________________________________________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液甲,溶液乙为0.1 mol/L的CH3COONa溶液,则两溶液中c(NO)、c(NO)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数Ka=1.7×10-5 mol/L)。可使溶液甲和溶液乙的pH相等的方法是______________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
28.解析:(1)Ⅰ.2NO(g)N2O2(g) ΔH1<0;Ⅱ.N2O2(g)+O2(g)2NO2(g) ΔH2<0,Ⅰ+Ⅱ可得:2NO(g)+O2(g)2NO2(g) ΔH=ΔH1+ΔH2,当该反应达到平衡时,v1正=v1逆,v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)×c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则K==;由于该反应的正反应为放热反应,所以升高温度,平衡向吸热的逆反应方向移动,使化学反应平衡常数减小;②2NO(g)+O2(g)2NO2(g)反应的快慢由反应速率慢的反应Ⅱ决定,所以反应的活化能E1CH3COOH,所以水解程度:CH3COO->NO,因此等浓度的CH3COONa、NaNO2中离子浓度c(CH
- 14 -
3COO-)c(NO)>c(CH3COO-);溶液甲是NaNO3和NaNO2的混合溶液,NaNO2水解使溶液显碱性,溶液乙为CH3COONa溶液,水溶液显碱性,由于CH3COONa水解程度大于NaNO2,所以碱性乙>甲,要使溶液甲和溶液乙的pH相等,可采用向甲溶液中加入适量的碱NaOH,使溶液的pH增大,也可以向乙溶液中加入适量的水进行稀释,使乙的pH减小,故选bc。
答案:(1)①ΔH1+ΔH2 减小 ②< a
(2)A O2+4e-+4H+===2H2O (3)c(NO)>c(NO)>c(CH3COO-) bc
(二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做则按所做的第一题计分。
35.【化学——选修3:物质结构与性质】(15分)
硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5 ℃)高于硫化氢的沸点(-60.4 ℃)的主要原因是_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1 mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。
35.解析:(1)基态S原子最外层有6个电子,排布在3s、3p能级上,所以基态S原子的价电子排布式为3s23p4;离原子核越远能量越高,能量最高的电子所处的能层是第三层,符号为M;(2)S原子的价电子对数是=4,孤对电子为0,所以SO空间构型正四面体; S原子轨道杂化方式为sp3;等电子体是指具有相同价电子数目和原子数目的分子或离子,所以与SO互为等电子体的分子的化学式是CCl4或SiF4;(3)氨气分子间有氢键,H2
- 14 -
S分子间没有氢键,所以氨气的沸点高于硫化氢的沸点;(4)N原子2p轨道为半充满状态,所以第一电离能大于相邻的O原子,同主族元素从上到下第一电离能逐渐减小,所以第一电离能O大于S原子,所以O、N、S的第一电离能从大到小的顺序是N>O>S;(5)Cu和N之间是配位键、N和H之间是共价键,单键都是σ键,所以1 mol的[Cu(NH3)4]2+中σ键的个数为16NA;(6)Ti原子数是12×+1=4、N原子数是6×=3、C原子数是8×=1,化学式是Ti4CN3;根据晶胞结构,若碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是顶点和前后左右面心。
答案:(1)3s23p4 M (2)正四面体 sp3 CCl4或SiF4等 (3)均为分子晶体,而氨气分子间有氢键,H2S分子间没有氢键 (4)N>O>S (5)16NA
(6)Ti4CN3 顶点和前后左右面心
36.【化学——选修5:有机化学基础】(15分)
化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:①RCHO+CH3CHORCH===CHCHO+H2O;②||+|||。
回答下列问题:
(1)C的结构简式为_________________________________________。
(2)F中官能团的名称为___________________________________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为______________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多少种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2===CHCOOCH3的合成路线(其他试剂任选)
________________________________________________________________________。
- 14 -
- 14 -
- 14 -
- 14 -
- 14 -
您可能关注的文档
- 广东省清远市方圆培训学校2020届高三化学模拟试题精练(十六) Word版含答案
- 政治(思想品德)(心得)之借题发挥让思想政治课活起来
- 当代大学生应怎样自觉维护网络生活中的道德要求?我国宪法宣誓制度适用的主体包括哪些?将每年的12月4日
- 2017-2018学年江苏省扬州中学高二上学期期中考试数学试题
- 精选20XX幼儿教育心得体会范文
- 2020年高中教师工作总结范文(通用)
- 精编【最新】20XX年上半年社区工作总结(2篇) 20XX疫情个人总结(一)
- 语文卷·2018届陕西省西安中学高三10月月考(2017-10)
- 部编版一年级上册语文汉语拼音《 i u ü y w 》课件 (9)
- 2020公司员工个人工作总结简短