- 330.89 KB
- 2023-11-26 发布
一、选择题
1.(原创题)单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③陶瓷是人
类应用很早的硅酸盐材料④单晶硅常用于制造光导纤维⑤二氧化硅是沙子、石英的主要成分
A.①③⑤ B.①②④ C.③④⑤ D.①④⑤
2.在一定条件下,下列物质不能和二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦水 ⑧氮气
A.③⑤⑦⑧ B.⑤⑦⑧ C.⑤⑧ D.⑤
3.(改编题)下列各项操作中,没有“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的 CO2 ②向 Fe(OH)3 胶体中逐滴加入过量的稀盐酸 ③向
AlCl3 溶液中逐滴加入过量 NaOH 溶液 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④ C.①③ D.②③
4.下列叙述正确的是( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸 C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
5.(2010·上海交大期中考试)宇航员在升空、返回或遇到紧急情况时,必须穿上 10 kg 重的舱
内航天服,神六宇航员所穿舱内航天服是由我国科学家近年来研制的新型“连续纤维增韧”航空
材料做成,其主要是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是( )
A.它耐高温,抗氧化 B.它是一种新型无机非金属材料
C.它没有固定熔点 D.它比钢铁轻、硬,但质地较脆
6.由我国成功发射的嫦娥一号探测卫星,主要用于对月球土壤中 14 种元素的分布及含量进
行探测等。月球的矿产资源极为丰富,仅月面表层 5 cm 厚的沙土就含铁单质上亿吨,月球上的
主要矿物有辉石(CaMgSi2O6)、斜长石(KAlSi3O8)和橄榄石(MgFeSiO4)等,下列说法或分析不正确
的是( )
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2 价
D.月球上有游离态铁是因为月球上铁的活泼性比地球上铁的活泼性弱
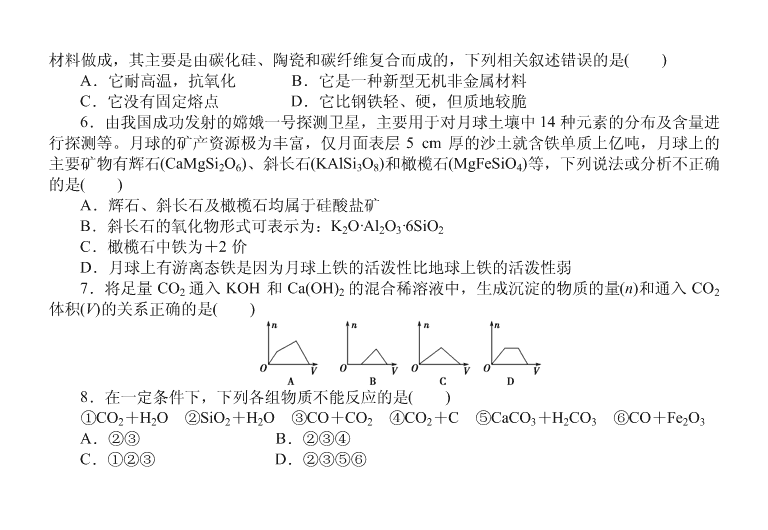
7.将足量 CO2 通入 KOH 和 Ca(OH)2 的混合稀溶液中,生成沉淀的物质的量(n)和通入 CO2
体积(V)的关系正确的是( )
8.在一定条件下,下列各组物质不能反应的是( )
①CO2+H2O ②SiO2+H2O ③CO+CO2 ④CO2+C ⑤CaCO3+H2CO3 ⑥CO+Fe2O3
A.②③ B.②③④
C.①②③ D.②③⑤⑥
9.(2011·济宁梁山模拟)绿柱石又称绿宝石,其主要成分为 BenAl2[Si6O18],也可以用二氧化
硅和金属氧化物的形式表示,则 n 为( )
A.1 B.2 C.3 D.4
10.能证明碳酸比硅酸酸性强的实验事实是( )
A.CO2 是气体,SiO2 是固体
B.高温下能发生反应 Na2CO3+SiO2=====高温 Na2SiO3+CO2↑
C.CO2 溶于水生成碳酸,而 SiO2 却不溶于水
D.CO2 通入 Na2SiO3 溶液中有胶状沉淀生成
二、非选择题
11.(2011·泰州模拟)(1)光导纤维的使用,让人们的生活更加丰富多彩,________(填化学式)
是制备光导纤维的基本原料。
(2)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源,与“氢能源”比较,“硅
能源”具有________等更加优越的特点,从而得到全球的关注和期待。
(3)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和
胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:____________________________。
12.(2010·南京模拟)已知 A~I 有如图所示转换关系:
已知:①单质 E 可作为半导体材料;
②化合物 F 是不能生成盐的氧化物;
③化合物 I 能溶于水呈酸性,它能够跟氧化物 A 起反应。
据此,请填空:
(1)化合物 F 是________。
(2)化合物 I 是________。
(3)反应③的化学方程式是_______________________。
(4)反应④的化学方程式是___________________。
(5)写出 I 的水溶液与 A 反应的方程式:_____________________________。
13. (改编题)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主
要方法,生产过程示意图如下:
石英砂 ――→焦炭
高温 粗硅 ――→HCl
573K 以上 SiHCl3粗 ――→精馏 SiHCl3纯 ――→H2
1 357K 高纯硅
①写出由纯 SiHCl3 制备高纯硅的化学反应方程式___________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3 遇水剧烈反应生成 H2SiO3、HCl 和另一种物
质,请补充完整化学方程式 SiHCl3+3H2O===____________;H2 还原 SiHCl3 过程中若混入 O2,
可能引起的后果是_____________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂组成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠的水溶液俗称水玻璃,取少量水玻璃于试管中,充入过量 CO2 气体,振荡,现象为
______________________。
离子方程式为_______________________________。
14.往 100 mL 的 NaOH 溶液中通入 CO2 充分反应后,在减压和较低温度下,小心地将溶液
蒸干,得到白色固体 M。通入的 CO2 的体积 V(标准状况)与 M 的质量(W)的关系如图所示。
试回答下列问题:
(1)A 点时,白色固体 M 的化学式为________,通入的 CO2 的体积为________mL(标准状况下,
下同)。
(2)C 点时,白色固体 M 的化学式为________,通入的 CO2 的体积为________mL。
(3)B 点时 M 的组成成分为________(用化学式表示)。
(4)该 NaOH 溶液的物质的量浓度为________。
答案及解析
1、【解析】 ②中水晶饰物不是硅酸盐制品;④中 SiO2 是制造光导纤维的原料。【答案】 A
2、【解析】 SiO2 为难溶的酸性氧化物,具备酸性氧化物的通性,例如跟碱反应、跟碱性氧
化物反应等,同时具有以下特性:①常温下与氢氟酸反应;②与碳酸盐、碳等反应需要高温条件。
【答案】 B
3、【解析】 向饱和碳酸钠溶液中通入过量的 CO2 生成碳酸氢钠,碳酸氢钠的溶解度小于碳
酸钠,所以可析出碳酸氢钠晶体(沉淀),再通入 CO2 沉淀不溶解;向 Fe(OH)3 胶体中逐滴加入过
量的稀盐酸,胶体发生聚沉生成 Fe(OH)3 沉淀,然后 Fe(OH)3 与盐酸反应而溶解;向 AlCl3 溶液中
滴加 NaOH 溶液,先生成 Al(OH)3 沉淀,然后 Al(OH)3 溶解于 NaOH 溶液;向硅酸钠溶液中逐滴
加入盐酸生成 H2SiO3 沉淀,H2SiO3 不溶解于过量的盐酸中。【答案】 B
4、【解析】 二氧化硅在高温下能与碳酸钠反应:Na2CO3+SiO2 高温,Na2SiO3+CO2↑,该
反应不是在溶液中进行的复分解反应,该反应虽然能进行但不能说明硅酸的酸性比碳酸强,上述
反应之所以能进行,是因为 CO2 不断逸出,反应向右进行。玻璃、陶瓷、水泥中均含有 SiO2,会
与 HF 反应。石灰抹墙发生反应 CO2+Ca(OH)2===CaCO3↓+H2O,而水泥砌墙是水泥与水作用
发生一系列变化而凝固变硬。【答案】 D
5、【解析】 航空材料的特点是轻质、高强度、高可靠性。故 A 正确、D 错;复合材料属于
混合物,没有固定的熔点,碳化硅、陶瓷和碳纤维复合而成的材料属于新型无机非金属材料,B、
C 正确。【答案】 D
6、【解析】 铁的活泼性是不会改变的,只是月球上没有氧气,故在月球上存在游离态铁,
D 错误。【答案】 D
7、【解析】 CO2+2OH-===CO2-
3 +H2O,Ca2++CO2-
3 ===CaCO3↓。故开始有沉淀生成。当
Ca2+全部变成 CaCO3 沉淀后,CO2 再与 OH-反应生成 CO2-
3 ,CO2 再与 CO2-
3 反应生成 HCO-
3 沉淀
无变化,最后 CaCO3+CO2+H2O===Ca(HCO3)2,沉淀溶解。【答案】 D
8、【解析】 ②中 SiO2 与 H2O 不反应,③中 CO 与 CO2 不反应,①中生成 H2CO3,④中生
成 CO,⑤中生成 Ca(HCO3)2,⑥中生成 Fe 和 CO2。【答案】 A
9、【解析】 BenAl2[Si6O18]写作氧化物形式为 nBeO·Al2O3·6SiO2,则由氧原子个数知:n+3
+6×2=18,n=3。【答案】 C
10、【解析】 酸性强弱与这种酸的氧化物所处的状态和化学活动性无关,所以 A、B 都不正
确;C 是它们的物理性质;只有 D 项是较强酸制弱酸的有力证据。【答案】 D
11、【解析】 (1)制光导纤维的基本原料是 SiO2。
(2)硅能源具有来源丰富,易开采、便于贮存、运输,产物污染小,反应易控制且放出大量的
热等优点。
(3)三硅酸镁与盐酸的反应为 2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+(n+2)H2O
【答案】 (1)SiO2
(2)来源丰富,易贮存、运输(其他合理答案亦可)
(3)2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+(n+2)H2O
12、【解析】 因单质 E 和化合物 F 分别是半导体材料和不成盐的氧化物,可考虑分别为 Si
和 CO,反应①的化学方程式为 SiO2+2C=====高温 Si+2CO↑,氧化物 A 为 SiO2,它除了能跟氢氟
酸反应以外不跟任何酸起反应,由此判断化合物 I 为 HF,依次类推 C 为 H2O、D 为 F2,H 为 O2。
【答案】 (1)CO (2)HF (3)2H2+O2=====点燃 2H2O(4)2F2+2H2O===4HF+O2
(5)4HF+SiO2===SiF4↑+2H2O
13、【解析】 (1)①H2 还原 SiHCl3 可制备 Si,化学方程式为 SiHCl3+H2 =====1 357KSi+3HCl
②SiHCl3 与 H2O 反应生成 H2SiO3、HCl 和 H2;用 H2 还原 SiHCl3 过程中若混入 O2,则高温下 H2
与 O2 反应发生爆炸。
(2)A 项,水泥为硅酸盐材料。B 项,氮化硅为原子晶体,熔点高,硬度大,可用于制作高温
陶瓷和轴承。D 项,普通玻璃的主要成分是 Na2SiO3、CaSiO3,是由石英砂(SiO2)、石灰石、纯碱
高温下反应产生的,化学方程式为 Na2CO3+SiO2=====高温 Na2SiO3+CO2↑,CaCO3+SiO2=====高温
CaSiO3+CO2↑,E 项,Si 与 HCl 在常温下不反应。
(3)因为 H2CO3 比 H2SiO3 酸性强,CO2 通入水玻璃中有 H2SiO3 生成。
【答案】 (1)①SiHCl3+H2 =====1 357 KSi+3HCl
②H2SiO3↓+3HCl↑+H2↑ 高温下 H2 与 O2 反应发生爆炸(2)B、C
(3)有白色沉淀生成 SiO2-
3 +2CO2+2H2O===H2SiO3↓+2HCO-
3
14、【解析】 本题考查了 CO2 与 NaOH 反应时产物与通入 CO2 量之间的关系,向 NaOH 溶
液中逐渐通入过量 CO2 发生的反应为:
CO2+2NaOH===Na2CO3+H2O CO2+H2O+Na2CO3===2NaHCO3
从图可知 NaOH 的质量为 4 g,n(NaOH)=0.1 mol,c(NaOH)=0.1 mol
0.1 L =1 mol/L。NaOH 完全
转化为 Na2CO3 时,m(Na2CO3)=5.3 g,A 点为 Na2CO3,V(CO2)=0.1 mol
2 ×22.4 L/mol=1.12 L=1
120 mL。完全转化为 NaHCO3 时,m(NaHCO3)=8.4 g,C 点为 NaHCO3,V(CO2)=0.1 mol×22.4
L/mol=2.24 L=2 240 mL,因 B 点时 M 质量为 7.16 g,5.3<7.16<8.4,知 M 为 Na2CO3 和 NaHCO3
的混合物。
【答案】 (1)Na2CO3 1 120 (2)NaHCO3 2 240 (3)Na2CO3、NaHCO3 (4)1 mol/L