- 971.74 KB
- 2021-06-03 发布
1
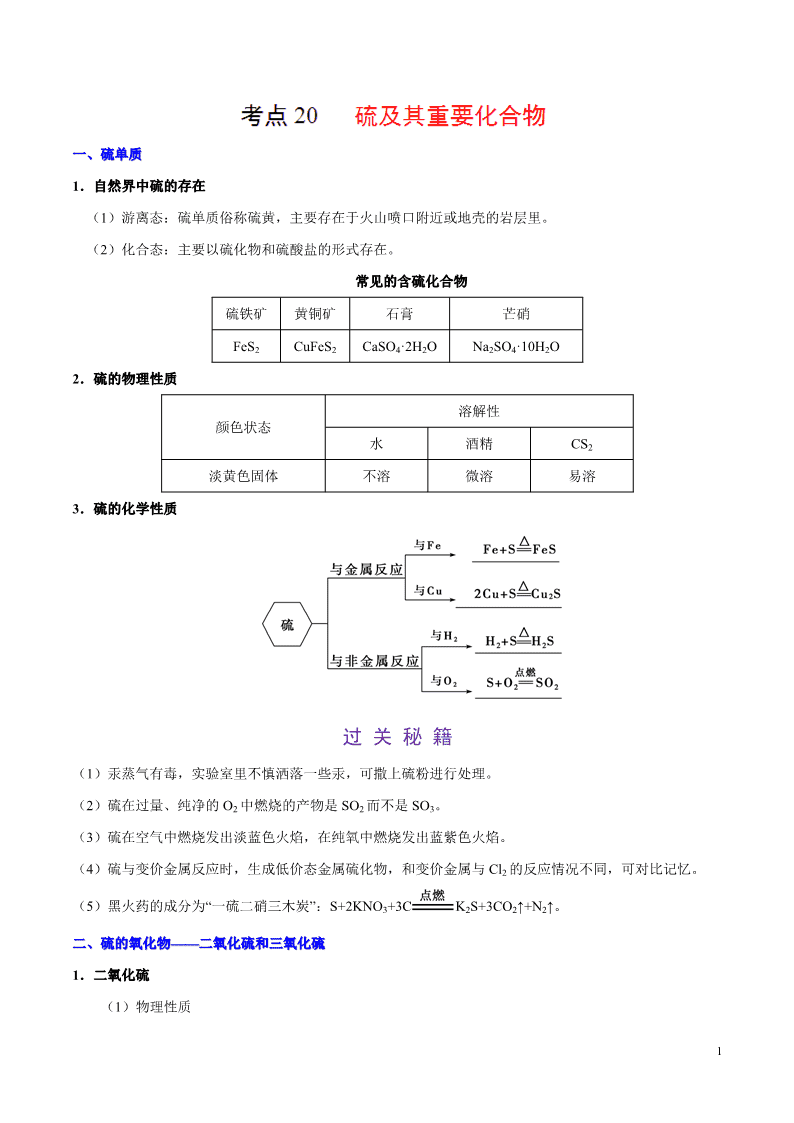
一、硫单质一、硫单质
1.自然界中硫的存在
(1)游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
常见的含硫化合物
硫铁矿 黄铜矿 石膏 芒硝
FeS2 CuFeS2 CaSO4·2H2O Na2SO4·10H2O
2.硫的物理性质
溶解性
颜色状态
水 酒精 CS2
淡黄色固体 不溶 微溶 易溶
3.硫的化学性质
过 关 秘 籍
(1)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(2)硫在过量、纯净的 O2 中燃烧的产物是 SO2 而不是 SO3。
(3)硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰。
(4)硫与变价金属反应时,生成低价态金属硫化物,和变价金属与 Cl2 的反应情况不同,可对比记忆。
(5)黑火药的成分为“一硫二硝三木炭”:S+2KNO3+3C K2S+3CO2↑+N2↑。
二、硫的氧化物二、硫的氧化物————二氧化硫和三氧化硫二氧化硫和三氧化硫
1.二氧化硫
(1)物理性质
2
颜色 状态 气味 密度 溶解性
无色 气体 刺激性 比空气大 易溶于水(常温常压下 1 体积水可溶解 40 体积 )
(2)化学性质
①酸性氧化物的通性
a.与水反应:SO2+H2O H2SO3
b.使指示剂变色:SO2 能使紫色石蕊溶液变红
c.与碱反应:NaOH 足量:SO2+2NaOH Na2SO3+H2O
NaOH 不足量:SO2+NaOH NaHSO3
d.与碱性氧化物反应:SO2+CaO CaSO3
②氧化性:2H2S+SO2 3S↓+2H2O(产生淡黄色沉淀)
③还原性
a.与 O2 反应:2SO2+O2 2SO3
b.与 X2(Cl2、Br2、I2)的水溶液反应:SO2+X2+2H2O 2HX+H2SO4
c.可被酸性 KMnO4 溶液、K2Cr2O7 溶液、H2O2、Fe3+等氧化。
④漂白性:SO2 能漂白某些有色物质(如品红溶液),但不能使紫色石蕊溶液等指示剂褪色。
(3)检验
将气体通入品红溶液后,溶液褪色,加热后溶液又恢复到红色则可验证该气体是 SO2。注意“加热”
是必不可少的步骤,因为氯气也能使品红溶液褪色,但加热后溶液不会重新变红色。
2.三氧化硫
(1)物理性质
常温常压下为无色、易挥发的液体,熔点为 16.8 ℃,沸点为 44.8 ℃。
(2)化学性质:酸性氧化物的通性
表现性质 方程式
与水反应,生成强酸 (工业生产硫酸)
与碱(如 )反应生成盐和水
2SO
2 4H SO 3 2 2 4SO H O H SO
NaOH 2
3 4 2SO 2OH SO H O
3
与碱性氧化物(如 )反应生成盐
与某些盐(如 )反应生成硫酸盐
三、硫酸的性质和三、硫酸的性质和 、、 的检验的检验
1.硫酸的性质
物理性质
纯净的硫酸是无色油状液体,沸点高,难挥发,密度大于水(98%的浓 H2SO4,密度为
1.84 g·cm−3),溶于水放出大量的热
能干燥 H2、O2、N2、CO2、Cl2、HCl、SO2、CO、CH4 等
碱性气体,如 NH3 等
吸水性
常用
作
干燥
剂
不能干
燥[来源:|网 Z|X|X|K] 还原性气体,如 H2S、HBr、HI 等
脱水性 将有机物中的氢、氧元素按原子个数 2∶1 的比例脱去,如蔗糖脱水炭化
与活泼金属
反应
2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O,常温下浓硫酸使 Fe、Al
钝化
与不活泼金
属反应
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
化
学
性
质
强氧化
性
与非金属反
应
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
不挥发性 用于制挥发性酸,如 H2SO4(浓)+NaCl NaHSO4+HCl↑
注意:(1)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。(2)常温下
铁、铝遇冷的浓硫酸发生“钝化”,但加热时剧烈反应。
2. 、 的检验方法
(1) 的检验方法
①原理: (白色)。
CaO 3 4CaO SO CaSO
△
2 3Na CO 2 2
3 3 4 2SO CO SO CO
2
3SO 2
4SO
微热
2
4SO 2
3SO
2
4SO
2 2
4 4Ba SO BaSO
4
②方法:取试样少许,先滴加稀盐酸无气泡、沉淀产生(排除 、 、 等离子的干扰),再
滴加 溶液,若产生白色沉淀,则含有 。
说明: 的检验试剂为组合型试剂,通常可分为 4 组:
a. 与 ,b. 与 ,c. 与 ,d. 与 。
选用时视具体情况而定。例如:当溶液中存在 、 时,只能选用 d 组试剂;当溶液中存在
时,只能选用 a 组试剂,因为 b、c、d 组试剂混合后均有 存在,而 能将 氧化成 ,
进而生成 沉淀。
(2) 的检验方法
①原理: ; , 。
②方法:取试样少许,加入稀盐酸,将产生的气体通入品红溶液,红色褪去;或加入 溶液生成
白色沉淀,再加入稀盐酸,沉淀溶解并产生具有刺激性气味的气体,则含有 。
四、硫及其化合物的转化四、硫及其化合物的转化
1. 基本转化规律
(1)同种价态之间的转化
硫元素的化合价相同的物质之间的转化,属于非氧化还原反应,主要试剂是酸、碱、盐、氧化物等。
(2)不同价态之间的转化
硫元素的化合价不同的物质之间的转化,属于氧化还原反应,主要试剂是氧化剂和还原剂。
2.价态变化规律
(1) 是硫元素的最低价态,只有还原性; 、 处于中间价态,既有氧化性,又有还原性; 是硫
元素的最高价态,只有氧化性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。
例如:
2
3CO 2
3SO Ag
2BaCl 2
4SO
2
4SO
2BaCl HCl 2BaCl 3HNO 3 2Ba NO HCl 3 2Ba NO 3HNO
Ag 2Hg 2
3SO
3HNO 3HNO 2
3SO 2
4SO
4BaSO
2
3SO
2
3 2 2SO 2H SO H O 2 2
3 3Ba SO BaSO 2
3 2 2BaSO 2H Ba H O SO
2BaCl
2
3SO
2
S
0
S
4
S
6
S
2 2 2
2 2
2 0 4 6O O O
2 2 3H H SH S S S O S O
不足
、△
2 4 2 2 22H SO C 2SO CO 2H O
△
浓
5
(3)有时硫的化合价发生跳位转化。如 、 遇到强氧化剂时可被氧化为+6 价: 、
。
(4)硫元素相邻价态的微粒之间不发生氧化还原反应。如 S 和 、S 和 、 和 之间
不发生氧化还原反应。
3.重要转化关系
(1)含−2 价硫元素的化合物之间的转化
(2)含+4 价硫元素的化合物之间的转化
(3)含+6 价硫元素的化合物之间的转化
(4)氧化还原反应转化关系
考向一 SO2 的特性
典例 1 某兴趣小组为探究 SO2 的性质,设计的装置如图所示,下列说法不正确的是
A.表明 I-的还原性弱于 SO2 的现象是 B 中的蓝色溶液褪色
2
S
0
S 3
0 HNO
2 4S H SO
2 6
S S
浓硝酸
2H S 2SO 2SO 2 4H SO
2
2 4 2 4
H O NaOH NaOH
2 2 3 3 2 3H SO H SOSO H SO NaHSO Na SO
溶液 溶液
△ 稀 稀
3 2 3 4 2 4 4SO H SO NaHSO Na SO BaSO
6
B.装置 C 的作用是吸收 SO2 尾气,防止其污染空气
C.为了验证 A 中发生了氧化还原反应,加入盐酸酸化的 BaCl2 溶液,产生白色沉淀
D.为了验证 A 中发生了氧化还原反应,加入 KMnO4 溶液,紫红色褪去
【答案】D
1.如图,利用培养皿探究 SO2 的性质。实验时向 Na2SO3 固体上滴几滴浓硫酸,立即用另一表面皿扣在上
面。
下表中对实验现象的描述或所做的解释不正确的是
选项 实验现象 解释
A BaCl2 溶液变浑浊 SO2 与 BaCl2 溶液反应产生了 BaSO3 沉淀
B Na2S 溶液变浑浊 SO2 与 Na2S 溶液反应产生了 S 单质
C 酸性 KMnO4 溶液褪色 SO2 具有还原性
D 品红溶液褪色 SO2 具有漂白性
SO2 的“漂白性”
SO2 能使许多有色物质“褪色”,但其“褪色”原理不同:
(1)还原性“褪色”:SO2 能使溴水、酸性 KMnO4 溶液褪色,利用 SO2 的还原性。
(2)漂白性“褪色”:SO2 能使品红溶液褪色,利用 SO2 的漂白性。
(3)酸性“褪色”:SO2 能使滴有酚酞的 NaOH 溶液褪色,利用 SO2 的酸性氧化物的性质。
7
考向二 SO2 与 CO2 的性质比较
典例 1 检验 SO2 中是否混有 CO2 气体,可采用的方法是
A.通过品红溶液
B.先通过足量 NaOH 溶液,再通入澄清石灰水
C.通过澄清石灰水
D.先通过过量酸性 KMnO4 溶液,再通过澄清石灰水
【答案】D
2.下列实验中能证明某气体为 SO2 的是[来源:ZXXK]
①使湿润的蓝色石蕊试纸变红 ②通入足量 NaOH 溶液中,再滴加 BaCl2 溶液,有白色沉淀生成,该沉
淀溶于稀盐酸 ③通入溴水中,能使溴水褪色,再滴加 Ba(NO3)2 溶液有白色沉淀产生 ④通入 H2S 溶液
中有沉淀产生
A.都能证明 B.都不能证明
C.③④均能证明 D.只有③能证明
鉴别 SO2 和 CO2 的方法
SO2 和 CO2 都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清的石灰
水鉴别 SO2 和 CO2。通常可用以下方法:(1)根据物理性质。CO2 无色无味;SO2 无色、具有刺激性气味。
(2)品红溶液。使品红溶液褪色的是 SO2;不能使品红溶液褪色的是 CO2。(3)酸性 KMnO4 溶液。使酸
性 KMnO4 溶液褪色的是 SO2;无明显现象的是 CO2。(4)溴水。使溴水褪色的是 SO2;无明显现象的是 CO2。
(5)硝酸酸化的硝酸钡溶液。产生白色沉淀的是 SO2;无明显现象的是 CO2。(6)FeCl3 溶液。溶液颜色
变浅的是 SO2;无明显现象的是 CO2。
考向三 的检验2
4SO
8
典例 1 为检验溶液中是否含有 ,四位同学分别设计了如下实验,且都认为如果观察到的现象与自己
的设计方案一致,即可确认溶液中含有 。其中正确的是
A.加入足量稀硝酸,无明显现象,再加入 BaCl2 溶液,产生白色沉淀
B.加入 Ba(NO3)2 溶液,产生白色沉淀,再加稀盐酸酸化,沉淀不溶解
C.加入足量稀盐酸,有气泡产生,再加入 BaCl2 溶液,产生白色沉淀
D.加入足量稀盐酸,无明显现象,再加入 BaCl2 溶液,产生白色沉淀
加入 BaCl2 溶液,产生白色沉淀,证明含有 ,D 正确。
【答案】D
3.对某酸性溶液(可能含有 Br−、 、H2SO3、 )分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入 BaCl2 溶液,产生的白色沉淀不溶于稀硝酸。
根据实验不能确认原溶液中是否存在的是
A.Br− B. C.H2SO3 D.
的检验误区
(1)只加可溶性钡盐,不酸化。误将 、 、 等干扰离子判断成 。因上述离子会
产生 BaCO3、Ba3(PO4)2、BaSO3 白色沉淀。
(2)误将 Ag+判断成 。如向待测液中滴加 BaCl2 溶液,再加稀盐酸,有白色沉淀,便断定含
。其错误是未注意当溶液中不含 ,而含 Ag+时也会产生同样的现象:Ag++Cl− AgCl↓(白色)。
2
4SO
2
4SO
2
4SO
2
4SO
4NH
2
4SO
4NH
2
4SO
2
3CO 3
4PO 2
3SO 2
4SO
2
4SO 2
4SO
2
4SO
9
(3)误将 判断成 。如向待测液中滴加用稀盐酸酸化的 Ba(NO3)2 溶液生成白色沉淀,便误
以为有 。该错误是未注意 在酸性环境中具有强氧化性,能将 氧化成 而产生干扰。
考向四 硫及其化合物的转化关系与实验的融合
典例 1 将燃煤排放的含有 SO2 的烟气通入海水(主要含 Na+、K+、Ca2+、Mg2+、Cl-、 、Br-、 、
等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是
A.天然海水显酸性
B.氧化过程中可能发生的离子反应为 2SO2+2H2O+O2 4H++2
C.排入大海的溶液与天然海水相比,只有 数量发生了变化[来源:]
D.若将氧化后的液体进行蒸发结晶,得到的晶体中 CaSO4 含量最高
【答案】B
4.利用 Y 形管与其他仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证 SO2 的氧化性(如图 1 所示)。
2
3SO 2
4SO
2
4SO
3NO 2
3SO 2
4SO
2
4SO 2
3CO
3HCO
2
4SO
2
4SO
10
将胶头滴管中浓硫酸分别滴入 Y 形管的两个支管中,所产生的两种气体相遇发生反应 SO2+2H2S
3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2 与 BaCl2 反应生成沉淀的条件(如图 2 所示)。SO2 通入 BaCl2 溶液并不产生沉淀,
再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y 形管产生另一种气体,则在其左右支管应
放置的药品是 和 ,导气管 A 的作用是 。
1.下列关于硫及其化合物的说法中不正确的是
A.硫粉在过量的纯氧中燃烧也不能生成三氧化硫
B.SO2 既可以是含硫物质的氧化产物,也可以是含硫物质的还原产物
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.自然界中存在可溶于 CS2 的游离态的硫
2.下列实验操作能够达到实验目的的是
A.实验室采用图①所示装置收集 SO2
B.可用图②所示装置比较 KMnO4、Cl2、S 的氧化性强弱
C.除去 NaHCO3 溶液中的 Na2CO3 可加入 Ca(OH)2 溶液后过滤
D.称取 0.40 g NaOH,放入 100 mL 容量瓶中,配制 0.10 mol·L-1 的 NaOH 溶液
3.下列实验报告记录的实验现象正确的是
11
4.一定量的 CuS 和 Cu2S 的混合物投入足量的 HNO3 中,收集到气体 V L(标准状况),向反应后的溶液中(存
在 Cu2+和 )加入足量 NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到 CuO 12.0 g,若上述气体为 NO
和 NO2 的混合物,且体积比为 1∶1,则 V 可能为
A.9.0 L B.13.5 L
C.15.7 L D.16.8 L
5.如图所示是一系列含硫化合物的转化关系(部分反应产物已略去),下列说法正确的是
A.反应①说明 SO2 具有漂白性,反应②说明 SO2 具有酸性
B.若反应②中生成物 n(Na2SO3)∶n(NaHSO3)=1∶1,则反应物 n(SO2)∶n(NaOH)=1∶2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收 SO2
6.将一定量的锌与 100 mL 18.5 mol·L-1 浓硫酸充分反应后,锌完全溶解,同时生成气体 A 33.6 L(标准状
况)。将反应后的溶液稀释至 1 L,测得溶液中氢离子浓度为 0.1 mol·L-1,则下列叙述错误的是
A.气体 A 为 SO2 和 H2 的混合物
B.气体 A 中 SO2 与 H2 的体积比为 5∶1
C.反应中共消耗 Zn 97.5 g
D.反应中共转移电子 3 mol
2
4SO
12
7.已知 CuSO4 CuO+SO2↑+SO3↑+ O2↑。某班化学学习小组称取 10.0 g CuSO4 粉末,用如图所示装置进行
加热至质量不再变化为止。甲、乙、丙、丁四个装置的质量变化数据如表所示。
装置 甲(耐高温试管+CuSO4) 乙 丙 丁
反应前 42.0 g 75.0 g 260.0 g 140.0 g
反应后 37.0 g 79.5 g 260.0 g 140.0 g
下列有关判断正确的是
A.装置丁的作用只是吸收 S 的氧化物尾气
B.生成的氧气在标准状况下的体积为 350 mL
C.生成的 CuO 为 6.0 g
D.甲中发生反应的化学方程式为 6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑[来源:Zxxk.Com]
8.用下图装置可以进行测定 SO2 转化成 SO3 的转化率的实验。已知 SO3 的熔点是 16.8 ℃,沸点是 445.8 ℃。
已知发生装置中所涉及反应的化学方程式为 Na2SO3(s)+H2SO4(98%)===Na2SO4+H2O+SO2↑。
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图 A~E 装置中选择最适合装置并将
其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是__________、__________、__________。
13
(2)从乙处均匀通入 O2,为使 SO2 有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应
采取的操作是_________________________________________________。
(3)将 SO2 通入含 1.5 mol 氯酸的溶液中,可生成一种强酸和一种氧化物,若有 1.5×6.02× 1023 个电子
转移时,该反应的化学方程式为______________________________。
(4)用 a mol Na2SO3 粉末与足量浓硫酸进行此实验,当反应结束时,继续通入 O2 一段时间后,测得装
置Ⅲ增重了 b g,则实验中 SO2 的转化率为________%(用含 a、b 的代数式表示)。
(5)尾端球形干燥管的作用是__________________________________________。
9.工业上常用铁质容器盛装冷的浓硫酸。为研究铁质材料与热的浓硫酸的反应,某学习小组进行了以下探
究活动:
探究一
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷的浓硫酸中,10 分钟后移入硫酸铜溶液中,片刻后取出
观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉(碳素钢)6.0 g 放入 15.0 mL 浓硫酸中,加热,充分反应后得到溶液 X,并收集到气体
Y。
①甲同学认 为 X 中除 Fe3+外还可能含有 Fe2+。若要确认其中的 Fe2+,应选用 (填字母)。
a.KSCN 溶液和氯水 b.铁粉和 KSCN 溶液
c.浓氨水 d.酸性 KMnO4 溶液
②乙同学取 336 mL(标准状况)气体 Y 通入足量溴水中,发生反应:SO2+Br2+2H2O 2HBr+H2SO4。然
后加入足量 BaCl2 溶液,经适当操作后得干燥固体 2.33 g。由此推知气体 Y 中 SO 2 的体积分数
为 。
探究二
分析上述实验中 SO2 体积分数的结果,丙同学认为气体 Y 中还可能含有 H2 和气体 Q。为此设计下列实
验探究装置(图中加热和夹持仪器已略去)。
(3)装置 B 中试剂的作用是 。
(4)认为气体 Y 中还含有气体 Q 的理由是 (用化学方程式表示)。
14
(5)为确认气体 Q 的存在,需在装置中添加 M,M 应该位于 (填字母)。
a.A 之前 b.A、B 之间 c.B、C 之间 d.C、D 之间
(6)如果气体 Y 中含有 H2,预计实验现象应是 。
(7)若要测定此 336 mL 气体中 H2 的含量(标准状况下约有 28 mL H2),能不能用托盘天平称量装置 D
或装置 E 反应前后的质量,根据质量差来计算?判断后说明原因: 。
1.[2017 北京]根据 SO2 通入不同溶液中实验现象,所得结论不正确的是
溶液 现象 结论
A 含 HCl、BaCl2 的 溶液 产生白色沉淀 SO2 有还原性
B H2S 溶液 产生黄色沉淀 SO2 有氧化性
C 酸性 KMnO4 溶液 紫色溶液褪色 SO2 有漂白性
D Na2SiO3 溶液 产生胶状沉淀 酸性:H2SO3>H2SiO3
2.[2016 上海]在硫酸工业生产中,为了有利于SO2 的转化,且能充分利用热能,采用了中间有热交换器
的接触室(见图)。下列说法错误的是
A.a、b 两处的混合气体成分含量相同,温度不同
B.c、d 两处的混合气体成分含量相同,温度不同
C.热交换器的作用是预热待反应的气体,冷却反应后的气体[来源:Z,xx,k.Com]
D.c 处气体经热交换后再次催化氧化的目的是提高 SO2 的转化率
3.[2015 上海]二氧化硫能使溴水褪色,说明二氧化硫具有
A.还原性 B.氧化性
C.漂白性 D.酸性
4.[2017 天津]H2S 和 SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的
排放,回答下列方法中的问题。
3FeCl
15
Ⅰ.H2S 的除去
方法 1:生物脱 H2S 的原理为:
H2S+Fe2(SO4)3 S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4 2Fe2(SO4)3 +2H2O
(1)硫杆菌存在时,FeSO4 被氧化的速率是无菌时的 5×105 倍,该菌的作用是______________。
(2)由图 3 和图 4 判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其
原因是______________。
方法 2:在一定条件下,用 H2O2 氧化 H2S
(3)随着参加反应的 n(H2O2)/n(H2S)变化,氧化产物不同。当 n(H2O2)/n(H2S)=4 时,氧化产物的分子式
为__________。
Ⅱ.SO2 的除去
方法 1(双减法):用 NaOH 吸收 SO2,并用 CaO 使 NaOH 再生
NaOH 溶液 Na2SO3 溶液
(4)写出过程①的离子方程式:____________________________;CaO 在水中存在如下转化:
CaO(s)+ H2O (l) Ca(OH)2(s) Ca2+(aq)+2OH−(aq)
从平衡移动的角度,简述过程②NaOH 再生的原理____________________________________。
方法 2:用氨水除去 SO2
(5)已知 25℃,NH3·H2O 的 Kb=1.8×10−5,H2SO3 的 Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为 2.0
mol·L−1,溶液中的 c(OH−)=_________________ mol·L−1。将 SO2 通入该氨水中,当 c(OH−)降至 1.0×10−7
mol·L−1 时,溶液中的 c( )/c( )=___________________。
硫杆菌
2SO
CaO
①
②
2
3SO
3HSO
16
1.【答案】A
【解析】SO2 与水反应生成 H2SO3,H2SO3 为中强酸,不与 BaCl2 溶液反应。
2.【答案】D
3.【答案】B
【解析】由①知溶液中一定含有 H2SO3,其加热分解产生的 SO2 可使品红溶液褪色;由②知溶液中一定
含有 。由③知原溶液中含有 Br−,再加 BaCl2 有白色不溶于 HNO3 的沉淀生成,说明此时溶液中含
,但可能是原溶液含有的,也可能是氯水氧化 H2SO3 产生的,故不能确定原溶液中是否存在的是
。*网
4.【答案】(1)管壁内有淡黄色固体生成 稀释浓硫酸,防止硫化氢被浓硫酸氧化
(2)浓氨水 碱石灰(或固体 NaOH、生石灰) 保持集气瓶内外气压平衡,以便左右两边产生的气体顺
利导入
【解析】(1)浓硫酸分别滴入 Y 形管的两个支管中,所产生的两种气体相遇发生反应 SO2+2H2S
3S+2H2O,反应生成 S,S 为淡黄色固体;H2S 具有强还原性,可与浓硫酸发生氧化还原反应 H2S+H2SO4(浓)
S↓+SO2+2H2O,所以有 FeS 的一侧应用水稀释。
(2)根据二氧化硫的性质推断,右侧 Y 型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓
氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于 BaCl2 溶液,得到碱性溶液,再通入二氧
化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与 BaCl2 溶液发生复分解反应,可以得到白
色 BaSO3 沉淀和 NH4Cl 溶液;容器内压强大,气体不容易导入,所以导气管 A 的作用是保持集气瓶内外
气压平衡,以便左右两边产生的气体顺利导入。
1.【答案】C
4NH
2
4SO
2
4SO
17
2.【答案】B
【解析】二氧化硫的密度大于空气的密度,应用向上排空气法收集,A 项错误;Ca(OH)2 溶液与 NaHCO3
和 Na2CO3 的溶液都发生反应,C 项错误;不能在容量瓶中进行溶解操作,D 项错误。
3.【答案】B
【解析】SO2 的水溶液呈酸性,能使石蕊试液变红色,但不能漂白石蕊试液;SO2 能漂白品红溶液,使
品红溶液褪色;SO2 的饱和溶液加入 BaCl2 溶液中,SO2 与 BaCl2 不反应,最终还是无色溶液;d 试管中
发生反应:SO2+2NaOH Na2SO3+H2O,Na2SO3 与 BaCl2 反应生成 BaSO3 沉淀。本题选 B。
4.【答案】A
【解析】若混合物全是 CuS,其物质的量为 12.0/80=0.15 (mol),转移电子数为 0.15×8=1.2 (mol)。收
集到的两种气体体积相等,则二者物质的量相等,设 NO、NO2 均为 x mol,由转移电子数守恒得 3x+x=
1.2,计算得 x=0.3,此时气体体积 V=0.6×22.4=13.44(L);若混合物全是 Cu 2S,其物质的量为 0.075
mol,转移电子数为 0.075×10=0.75(mol),同理,设 NO、NO 2 均为 y mol, 3y+y=0.75,计算得 y=
0.187 5,气体体积 V=0.375×22.4=8.4(L),则 V 在 8.4~13.44 L 之间,因此选 A。
5.【答案】D
【解析】反应①中溶液先变蓝后褪色的原因是 KIO3 被还原先得到 I2,最终得到 I-,体现了 SO2 的还原性,
反应②是酸性氧化物和碱的反应,体现了 SO2 的酸性,A 项错误;根据元素守恒,当 n(Na2SO3)∶
n(NaHSO3)=1∶1 时,n(SO2)∶n(NaOH)=2∶3,B 项错误;反应④是非氧化还原反应,C 项错误;反应②
吸收了二氧化硫,反应④放出了 SO2,可以通过反应②④回收二氧化硫,D 项正确。*网
6.【答案】B
【解析】本题易错之处是忽视 H2SO4 的氧化性会随着浓度减小而发生变化,还原产物会由二氧化硫变为
氢气。根据题中信息可知,硫酸过量。反应消耗的 H2SO4 为(18.5×0.1- ) mol=1.8 mol,若生成的气体 A
仅为 SO2,SO2 的体积应为 ×22.4 L=20.16 L≠33.6 L,故不可能全是 SO2 气体,随着 H2SO4 浓度变小,
锌与稀硫酸反应会生成 H2,A 项正确。设生成的 SO 2 为 x mol,H2 为 y mol,则 x+y= =1.5。设参加
反应的 Zn 为 a mol,根据得失电子守恒有 2x+2y=2a,解得 a=1.5,故消耗 Zn 的质量为 1.5 mol×65
g·mol-1=97.5 g,C 项正确。反应中转移电子为 2a mol=3 mol,D 项正确。生成 x mol SO2 所消耗的 H2SO4
为 2x mol,生成 y mol H2 所消耗的 H2SO4 为 y mol,故 2x+y=1.8,x+y=1.5,解得 x=0.3,y=1.2,所以 SO2
与 H2 的体积比为 1∶4,故 B 项错误。本题选 B。
7.【答案】B
0.1
2
1.8
2
33.6
22.4
18
8.【答案】(1)B A E(或 C)
(2)先加热催化剂再滴入浓硫酸
(3)SO2+2HClO3===H2SO4+2ClO2
(4)
(5)防止空气中的 CO2 及水蒸气干扰,造成误差
【解析】(1)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3 的熔点是
16.8 ℃,可以用冰水冷却来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,可以用碱石灰或者
氢氧化钠溶液来进行尾气处理。(2)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催
化剂再滴入浓硫酸。(3)将 SO2 通入含 1.5 mol 氯酸的溶液中,可生成一种强酸和一种氧化物,强酸是
硫酸。若有 1.5×6.02×1023 个电子即 1.5 mol 电子转移,这说明 1 mol 氯酸得到 1 mol 电子,则氯元素的化
合价从+5 价降低到+4 价,因此氧化物是 ClO2,该反应的化学方程式为 SO2+2HClO3===H2SO4+2ClO2。
(4)根据硫原子守恒,Na2SO3~SO2~SO3,a mol Na2SO3 粉末与足量浓硫酸进行此实验,当反应结束
时,应产生二氧化硫的质量为 64a g,测得装置Ⅲ增重了 b g,即为剩余二氧化硫的质量,所以参加反应
的二氧化硫的质量为(64a-b) g,所以转化率 α= ×100%= %。(5)由于空气中含有
水蒸气及 CO2 等,所以尾端球形干燥管的作用是防止空气中的 CO2 及水蒸气干扰,造成误差。
9.【答案】(1)铁钉表面被氧化
(2)①d ②66.7%
(3)检验 SO2 是否除净*网
(4)C+2H2SO4(浓) CO2↑+ 2SO2↑+2H2O
(5)c
(6)装置 D 中固体由黑色变为红色和装置 E 中固体由白色变为蓝色
(7)不能,混合气体中 n(H2)= =0.001 25 mol,装置 D 中反应前后的质量差为 CuO 中 O
的质量,即为 0.001 25 mol×16 g·mol-1=0.02 g,或装置 E 中反应前后的质量差为 H2O 的质量,即为 0.001
1600 25
16
a b
a
64
64
a b
a
1600 25
16
a b
a
3
1
28 10 L
22.4 L mol
19
25 mol×18 g·mol-1=0.022 5 g,而以 g 为单位时,托盘天平只能估读到小数点后一位数
1.【答案】C
【名师点睛】掌握 SO2 的性质特点是解答的关键,选项 C 是易错点,要明确并不是遇到褪色就是漂白,
要搞清楚反应的原理以及常见的漂白剂。SO2 通入下列溶液中的现象与其体现的性质归纳如下:
溶液 石蕊试液
加有酚酞的
NaOH 溶液
酸性 KMnO4
溶液
溴水
品红
溶液
氢硫酸
(H2S 溶液)
现象 变红 褪色 褪色 褪色 褪色 生成浅黄色沉淀
性质 酸性氧化物 酸性氧化物 还原性 还原性 漂白性 氧化性
2.【答案】B
20
【解析】A.根据装置图可知,从 a 进入的气体是含有 SO2、O2、N2 等的冷气,经过热交换器后从 b 处
出来的是热的气体,成分与 a 处相同,正确;B.在 c 处出来的气体 SO2、O2 在催化剂表面发生反应产
生的含有 SO3 及未反应的 SO2、O2 等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3
变为液态,故二者含有的气体的成分不相同,错误;C.热交换器的作用是预热待反应的冷的气体,同
时冷却反应产生的气体,为 SO3 的吸收创造条件,正确;D.处气体经过热交换器后再次被催化氧化,
目的就是使未反应的 SO2 进一步反应产生 SO3,从而可以提高 SO2 的转化率,正确。故选 B。*网
3.【答案】A
【解析】二氧化硫使溴水褪色是因为发生了氧化还原反应,二氧化硫作还原剂,具有还原性。
4.【答案】(1)降低反应活化能(或作催化剂)
(2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
(3)H2SO4
(4)2OH−+SO2 +H2O
与 Ca2+生成 CaSO3 沉淀,平衡向正向移动,有 NaOH 生成
(5)6.0×10−3 0.62
(4)过程①是 NaOH 与 SO2 的反应,反应的离子方程式为 2OH−+SO2 +H2O;根据 CaO 在水
中的转化:CaO(s)+H2O(l) Ca(OH)2(s) Ca2+(aq)+2OH−(aq),过程②中 Na2SO3 加入 CaO 后,
与 Ca2+生成 CaSO3 沉淀,平衡向正向移动,有 NaOH 生成。
(5)根据 NH3·H2O 的 Kb=1.8×10−5 可知, =1.8×10−5,当氨水的浓度为 2.0 mol·L−1 时,
溶液中的 c(OH−)= c( )= =6.0×10−3 mol·L−1。
2
3SO
2
3SO
2
3SO
2
3SO
4
3 2
(NH ) (OH )
(NH H O)
c c
c
4NH 5 11.8 10 2.0 mol L
21
根据 H2SO3 的 Ka2=6.2×10−8 可知, =6.2×10−8 ,当 c(OH−) 降至 1.0×10−7 mol·L−1 ,则
c(H+)=1.0×10−7 mol·L−1,溶液中的 c( )/c( )=0.62。*网
【名师点睛】本题以真实化学问题为载体,考查应用实践能力。从化学特点出发,牢牢把握化学的应用
性,广泛联系实际创设化学应用情境,引领考生正确认识化学对社会发展和人类进步的巨大贡献,认识
化学的价值。要求考生将基础化学、基本化学原理和方法运用到实际生产生活中,解释生活中相关的现
象,解决工业生产的问题。题目中化学反应速率的影响因素,条件的选择,各种平衡常数的计算等为高
频考点,掌握平衡的定量定性分析为解题的关键,注意平衡常数的应用。
2-
3
-
3
(H+) (SO )
(HSO )
c c
c
2
3SO
3HSO