- 285.50 KB
- 2021-05-26 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
化学反应速率
(建议用时:35分钟)
1.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( )
A.使用光催化剂不改变反应速率
B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
C [催化剂可以改变反应速率,但不影响反应的转化率,A、B错误;对气体参加的反应,改变压强可以改变反应速率,D错误。]
2.以下是几位同学在学习化学反应速率理论后发表的一些看法,其中不正确的是 ( )
A.化学反应速率理论可指导怎样提高原料的转化率和生成物的产率
B.化学反应速率理论可以指导怎样在一定时间内快出产品
C.影响化学反应速率的主要因素是反应物的性质,浓度、温度、催化剂、反应物颗粒大小等外部因素也会对化学反应速率产生影响
D.正确利用化学反应速率理论可提高化工生产的综合经济效益
[答案] A
3.(2019·太原模拟)在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)W(s)+3H2O(g),下列说法不正确的是( )
A.增加H2O(g)的量,消耗H2的速率不变
B.将容器的体积缩小一半,其反应速率加快
C.保持体积不变,充入氩气,其反应速率不变
D.保持压强不变,充入氖气,H2O(g)的生成速率减慢
[答案] A
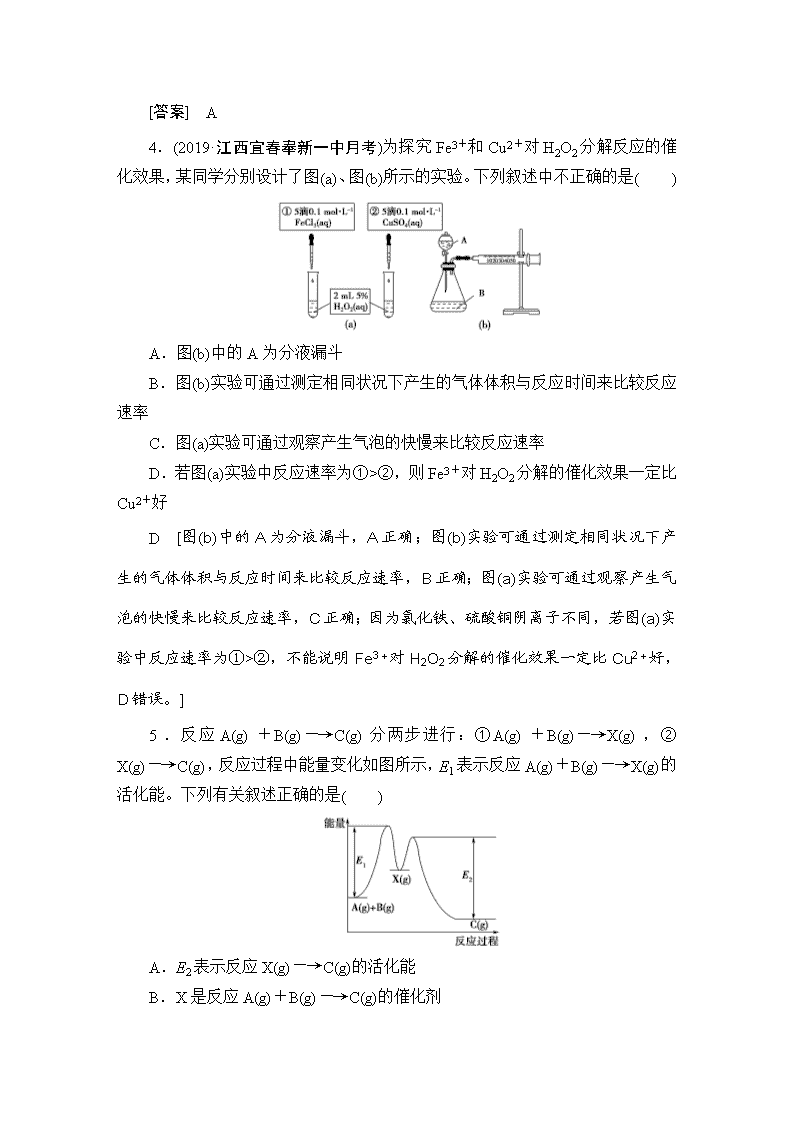
4.(2019·江西宜春奉新一中月考)为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图(a)、图(b)所示的实验。下列叙述中不正确的是( )
A.图(b)中的A为分液漏斗
B.图(b)实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.图(a)实验可通过观察产生气泡的快慢来比较反应速率
D.若图(a)实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
D [图(b)中的A为分液漏斗,A正确;图(b)实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率,B正确;图(a)实验可通过观察产生气泡的快慢来比较反应速率,C正确;因为氯化铁、硫酸铜阴离子不同,若图(a)实验中反应速率为①>②,不能说明Fe3+对H2O2分解的催化效果一定比Cu2+好,D错误。]
5.反应A(g)+B(g)―→C(g)分两步进行:①A(g)+B(g)―→X(g),②X(g)―→C(g),反应过程中能量变化如图所示,E1表示反应A(g)+B(g)―→X(g)的活化能。下列有关叙述正确的是( )
A.E2表示反应X(g)―→C(g)的活化能
B.X是反应A(g)+B(g)―→C(g)的催化剂
C.反应A(g)+B(g)―→C(g)的ΔH<0
D.加入催化剂可改变反应A(g)+B(g)―→C(g)的焓变
C [
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能,由图像可知,E2表示反应C(g)―→X(g)的活化能,A项错误;X是反应A(g)+B(g)―→C(g)的中间产物,B项错误;由图像可知,反应物总能量高于生成物总能量,故该反应是放热反应,ΔH<0,C项正确;催化剂只改变反应速率,不改变反应的焓变,D项错误。]
6.(2019·衡水模拟)在一定的条件下,在2 L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)。反应时间与残留固体的质量关系如图所示。下列说法正确的是( )
A.升高温度时,正反应速率增大,逆反应速率减小
B.随着反应的进行,混合气体的平均相对分子质量增大
C.增加硫酸镁的质量时,正反应速率将增大
D.在0~10 min内,v(CO)=0.01 mol·L-1·min-1
B [A项,升温,v正、v逆均增大,错误;C项,增加固体的量,v不变,错误;D项,
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) Δm
120 g 1 mol 40 g 80 g
n(CO) 8 g
n(CO)=0.1 mol,v(CO)==0.005 mol·L-1·min-1,错误。]
7.(2019·广州模拟)少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CuO固体 ⑤加NaCl固体 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol·L-1的盐酸
A.①⑤⑦ B.②④⑥
C.③⑦⑧ D.③⑥⑦⑧
C [加H2O,反应变慢;加NaOH,反应变慢;加CuO,改变H2的量;加NaCl,不影响反应;滴加CuSO4溶液,改变H2的量。]
8.(2019·安庆模拟)已知NO2与N2O4可相互转化:2NO2(g) N2O4(g) ΔH
=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是( )
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol·L-1·min-1
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v(正)与v(逆)均相等
D.25 min时,正反应速率减小
B [根据反应达到平衡后物质的浓度之比,可知初始反应浓度增加的曲线表示NO2变化曲线,前10 min内,v(NO2)=0.04 mol·L-1·min-1;反应进行到10 min时,NO2增加0.8 mol,吸收热量为9.68 kJ;a、b、c、d四点中只有b和d两点位于平衡状态,只有该两点正、逆反应速率相等;25 min时增加NO2的浓度,正反应速率增大。]
9.反应aA+bBcC在体积为2 L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如图所示:
请回答下列各题:
(1)反应的化学方程式为__________________________________________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列顺序为________,可能原因是__________________________________________________________
___________________________________________________________________。
(3)第Ⅰ阶段C的平均速率v1(C)=________。
(4)第Ⅱ阶段,B的转化率为________。
[解析] (1)反应达到平衡时,Δn(A)=2.0 mol-1.0 mol=1.0 mol,Δn(B)=6.0 mol-3.0 mol=3.0 mol,Δn(C)=2.0 mol-0 mol=2.0 mol,则Δn(A)∶Δn(B)∶Δn(C)=1.0 mol∶3.0 mol∶2.0 mol=1∶3∶2,即该反应的化学方程式为A+3B2C。
(2)vⅠ(A)==0.025 mol·L-1·min-1,
vⅡ(A)==0.012 7 mol·L-1·min-1,
vⅢ(A)==0.006 mol·L-1·min-1。
故:vⅠ(A)>vⅡ(A)>vⅢ(A)
(3)vI(C)==0.05 mol·L-1·min-1
(4)α(B)=×100%=38%。
[答案] (1)A+3B2C
(2)vⅠ(A)>vⅡ(A)>vⅢ(A) 随着反应的进行,反应物浓度逐渐变小
(3)0.05 mol·L-1·min-1
(4)38%
10.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)比较t2时刻,正逆反应速率大小v正________v逆。(填“>”“=”或“<”),理由是______________________________________________________________
___________________________________________________________________。
(2)若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为_______________________________________________________________。
(3)t3时刻化学反应达到平衡,反应物的转化率为_____________________。
(4)如果升高温度,则v逆________(填“增大”“减小”或“不变”)。
[解析] (1)t2
时刻,反应物逐渐减小,生成物逐渐增多,反应未达平衡且正向进行,v正>v逆。
(2)v===0.25 mol·L-1·min-1。
(3)t3时刻化学反应达到平衡,剩余2 mol N,则转化6 mol N,转化率为×100%=75%。
(4)升高温度,反应速率增大。
[答案] (1)> t2时未达平衡,v正减小,v逆增大
(2)0.25 mol·L-1·min-1 (3)75%
(4)增大
11.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示, 下列说法正确的是( )
图1 图2
A.由图1可知ΔH1=ΔH+ΔH2
B.加入Pt2O+,可使反应的焓变减小
C.为了实现转化需不断补充Pt2O+和Pt2O
D.由图2可知正反应的活化能小于逆反应的活化能
D [由图1可得①N2O(g)+Pt2O+(s)===Pt2O(s)+N2(g) ΔH1,②Pt2O(s)+CO(g)===Pt2O+(s)+CO2(g) ΔH2,根据盖斯定律,由①+②得N2O(g)+CO(g)===CO2(g)+N2(g) ΔH=ΔH1+ΔH2,A项错误;由图1可知,Pt2O+参与反应后又生成,Pt2O+是总反应的催化剂,Pt2O是中间产物,均不需要补充,催化剂只能改变反应的途径,不能改变反应的焓变,B、C项错误;ΔE1为正反应的活化能,ΔE2为逆反应的活化能,正反应的活化能较小,D项正确。]
[教师用书独具]
已知反应:2NO(g)+2H2(g)===N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)·cy(H2),k为速率常数。在800 ℃
时测得的相关数据如下表所示。
实验
数据
初始浓度
生成N2的初始速
率/(mol·L-1·s-1)
c(NO)/
(mol·L-1)
c(H2)/
(mol·L-1)
1
2.00×10-3
6.00×10-3
1.92×10-3
2
1.00×10-3
6.00×10-3
4.80×10-4
3
2.00×10-3
3.00×10-3
9.60×10-4
下列说法中不正确的是 ( )
A.关系式中x=1、y=2
B.800 ℃时,k的值为8×104
C.若800 ℃时,初始浓度c(NO)=c(H2)=4.00×10-3 mol·L-1,则生成N2的初始速率为5.12×10-3 mol·L-1·s-1
D.当其他条件不变时,升高温度,速率常数将增大
A [由实验数据1和2可知,c(H2)不变,c(NO)扩大1倍,反应速率扩大为原来的=4倍,则x=2,由实验数据1和3可知,c(NO)不变,c(H2)扩大1倍,反应速率扩大为原来的=2倍,则y=1,A项错误;根据数据1可知800 ℃时,k的值为==8×104,B项正确;若800 ℃时,初始浓度c(NO)=c(H2)=4.00×10-3 mol·L-1,则生成N2的初始速率v=k×c2(NO)×c(H2)=[8×104×(4.00×10-3)2×(4.00×10-3)]mol·L-1·s-1=5.12×10-3 mol·L-1·s-1,C项正确;温度升高,反应速率加快,则当浓度和其他条件不变时,升高温度,速率常数一定是增大的,D项正确。]
12.(2019·广州模拟)在一个容积固定为2 L 的密闭容器中,发生反应:aA(g)+bB(g) pC(g) ΔH=?反应情况记录如下表:
时间
c(A)/(mol·L-1)
c(B)/(mol·L-1)
c(C)/(mol·L-1)
0 min
1
3
0
第2 min
0.8
2.6
0.4
第4 min
0.4
1.8
1.2
第6 min
0.4
1.8
1.2
第8 min
0.1
2.0
1.8
第9 min
0.05
1.9
0.3
请仔细分析,根据表中数据,回答下列问题:
(1)第2 min到第4 min内用A表示的平均反应速率v(A)=________
mol·L-1·min-1。
(2)由表中数据可知反应在第4 min到第6 min时处于平衡状态,若在第2 min、第6 min、第8 min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2 min________或________;
②第6 min________;
③第8 min________。
[解析] (1)v(A)==0.2 mol·L-1·min-1。
(2)①从2~4 min来看,A、B、C的浓度变化量比前2 min 大,说明反应速率加快了,故2 min时改变的条件可能为使用催化剂或升高温度。②第6 min改变条件后,达到第8 min时,作为反应物,A的浓度减少而B的浓度增加,可知改变的条件为增加B的浓度。③从0~2 min来看,A、B、C的浓度变化量分别为0.2 mol·L-1、0.4 mol·L-1、0.4 mol·L-1可知a、b、p分别为1、2、2,从第9 min的数据来看,C的浓度大幅度减小,而A、B浓度也减小,且减小量与化学方程式中化学计量数成正比,可知第8 min改变的条件为减小C的浓度。
[答案] (1)0.2 (2)①使用催化剂 升高温度 ②增大B的浓度 ③减小C的浓度
13.(2019·安阳模拟)利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。已知增大催化剂的比表面积可提高化学反应速率。为
了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在实验设计表中。
实验编号
Ⅰ
Ⅱ
Ⅲ
T/℃
280
350
NO初始浓度/(mol·L-1)
1.2×10-3
1.2×10-3
CO初始浓度/(mol·L-1)
5.8×10-3
催化剂的比表面积/(m2·g-1)
82
124
82
(1)请填全表中的各空格。
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
[解析] (1)在其他量相同的情况下,才能判断变量对速率的影响,要验证温度对速率的影响,催化剂的比表面积、反应物的初始浓度等要相同;同理,验证催化剂的比表面积对速率的影响,温度、反应物的初始浓度要相同。(2)Ⅰ、Ⅱ的区别是催化剂的比表面积不同,因此Ⅱ的反应速率较快,但催化剂不影响平衡的移动。Ⅰ、Ⅲ的区别是温度变化,温度升高,化学反应速率加快,达到平衡的时间缩短,NO转化率降低,故最终Ⅲ中c(NO)较Ⅰ、Ⅱ中c(NO)大。
[答案] (1)
实验编号
Ⅰ
Ⅱ
Ⅲ
T/℃
280
NO初始浓度/(mol·L-1)
1.2×10-3
CO初始浓度/(mol·L-1)
5.8×10-3
5.8×10-3
(2)